Анемия пернициозная (В12-дефицитная, фолиеводефицитная, мегалобластная)
Длинный, но не полный список диагнозов-синонимов, послуживший заголовком статьи, нуждается в комментарии; попутно прояснится и содержание этих терминов.
Из чего состоит наша кровь, в чем заключается ее биологическая роль, что такое анемия – этим вопросам посвящены материалы «Клинический анализ крови» и «Анемия. Кровь и бескровие». Более подробно о витаминах группы В можно узнать из статей «Витамин В. Гиповитаминоз» и «Витамин В. Гипервитаминоз».
Пернициозная в переводе с латыни на русский означает «опасная», а в переводе на медицинский – «тяжелая, протекающая злокачественно, прогностически неблагоприятная».
Мегалобластная (иногда пишут «мегалобластическая») означает, что в костном мозге находится большое количество крупных клеток, представляющих собой «недоэритроциты» – одну из промежуточных, незрелых форм красных кровяных телец.
В12 – это витамин (понятно, какой группы), иначе называемый фактором Касла и представленный четырьмя различными кобальтсодержащими веществами с одинаковыми биологическими свойствами, что и позволило выделить их в единую подгруппу витамина В.
Фолиевая (досл. «лиственная») кислота – витамин той же группы, а именно В9.
Таким образом, получаем: опасная, злокачественно протекающая В-витаминодефицитная незрело-эритроцитная анемия. Раньше ее так и называли: злокачественная анемия или злокачественное малокровие. Но еще ее называют болезнью Аддисона-Бирмера или бирмеровой анемией, и вот почему.
В 1822 году симптомы некоего тяжелого заболевания крови впервые упомянул английский врач Дж.С.Комб. В 1849 году его соотечественник, выдающийся врач и ученый Томас Аддисон дал более развернутое описание и толкование. Существенно позже, – в 1871 году, но независимо от Аддисона, – немецкий исследователь Микаэль Антон Бирмер в деталях изучил и охарактеризовал это заболевание, которому дал название прогрессирующая пернициозная анемия.
Позже лечение от анемии напряженно искал американец Уильям Мерфи (от анемии вообще, без нозологического деления), производя эксперименты на искусственно обескровленных собаках. Мерфи кормил их различными продуктами и сравнивал темпы восстановления; его внимание обратила на себя сырая печень. С 1920-х годов усилиями У.Мерфи, Дж.Уиппла и Дж.Майнота пернициозная анемия перестала быть однозначно и стопроцентно летальной болезнью: спасительное лекарство крылось именно в печени. А закончилось все тем, что Мерфи, Уиппл и Майнот в 1934 году получили Нобелевскую премию, – за то, что выделили вещество (группу соединений, как выяснилось), известное сегодня под названием витамин В12.
Параллельно с этими работами анемией занимался американский ученый Уильям Босуорт Касл, о котором в мемориальной публикации Национальной Академии наук США (2018) говорится так: «Из сугубо описательного искусства он трансформировал гематологию в динамичную междисциплинарную науку» . Кроме прочего, У.Б.Касл однажды поставил на себе самом и группе пациентов-добровольцев не слишком аппетитный опыт (связанный с поглощением и отрыгиванием, через час, сырого мяса, которое затем использовалось в качестве лечения от тяжелой анемии). Этот странный эксперимент, тем не менее, был гениальной идеей: Касл неоспоримо доказал, что для превращения сырого мяса в подлинное лекарство оно должно побывать в желудке – где содержится некий обрабатывающий, активирующий реагент. Этот желудочный фермент, гастромукопротеид, сегодня известен во всем мире под названием «внутренний фактор Касла», тогда как «внешним фактором Касла» называют витамин В12 как таковой.
В серии статей о витаминах Лахта Клиника неоднократно обращала внимание на то, что история открытия и изучения этих удивительных веществ оказалась очень непростой, извилистой, порой драматичной. Но человечество вообще и медицина в частности отличаются невероятным самосохранительным упрямством, когда что-то угрожает нам по-настоящему. Сегодня на очереди сердечнососудистая патология, злокачественные опухоли, вирусные гепатиты, аутоиммунные и наследственные болезни. И никуда, образно говоря, эти убийцы от нас не спрячутся, – как не спрятались чума и лепра, авитаминозы и анемии: истинные причины будут изобличены, патогенез досконально изучен, лекарства найдены. Поскорее бы только, господа ученые. Поскорее бы. Мы знаем, что делается все мыслимое и немыслимое; знаем, что где-то в лабораториях, клиниках, университетских центрах морщат высокие лбы и трут воспаленные от бессонницы глаза современные Каслы, Аддисоны, Бирмеры, Дженнеры, Мечниковы, Флемминги. И все-таки – поторопитесь, пожалуйста…
Возвращаясь к запутанной проблеме В12-дефицитной анемии: анемия пернициозная – это не синоним, это частный случай. Как уже ясно из сказанного, недостаток кобальтсодержащих витаминов и фолиевой кислоты в организме может быть обусловлен двумя принципиально разными причинами.
Причины
Первая причина – дефицит внешнего фактора Касла, каковой фактор должен регулярно поступать с пищей. В сравнении с другими незаменимыми нутриентами, фолатов и витаминов В12 нужно не так много, но все-таки они жизненно необходимы. Соответственно, их дефицит может быть обусловлен недостаточным и несбалансированным питанием (в том числе вегетарианством, отказом от пищи ради «модельной фигуры», нервно-психической анорексией и т.п.).
Вторая группа причин значительно обширней: она охватывает множество заболеваний и состояний, снижающих концентрацию внутреннего фактора Касла, – желудочного мукопротеида, без которого даже при достаточном поступлении витаминов В9 и В12 невозможно их усвоение. К таким состояниям относится ряд желудочно-кишечных заболеваний, особенно тех, что поражают тонкий кишечник (в т.ч. инфекционные энтериты, болезнь Крона и мн.др.); постоперационные синдромы, связанные с частичной резекций желудка и/или кишечника; патология печени (в печени содержится депо данной группы витаминов, которого хватает на несколько лет). Недостаток транскобаламина (белка, осуществляющего транспорт витаминов В12) в редких случаях может быть наследственным. К нарушениям метаболизма внешнего фактора Касла приводит также избыточный и слишком продолжительный прием антибиотиков, антацидов, пероральных контрацептивов; гельминтозы; гиперактивность некоторых бактериальных культур; аутоиммунные расстройства; онкопроцессы; химические ожоги слизистой желудка; алкоголизм.
Потребность в фолатах и В12 возрастает при беременности.
Распространенность данной разновидности анемии в общей популяции оценивается на уровне 1%, с преобладанием женщин. В выборках пожилого и старческого возраста доля лиц с В12-дефицитной анемией возрастает до 10% и более, – за счет инволюционных изменений в тканях, секреторных процессах и общем метаболизме.
Симптоматика
Помимо общеанемической симптоматики, обусловленной хроническим кислородным голоданием тканей (астенический синдром, признаки дыхательной недостаточности, кардиальные нарушения), типичными симптомами пернициозной анемии выступают поражение желудочно-кишечного тракта, центральной и периферической нервной системы. Характерен «лакированный» малиновый язык (глоссит, воспаление), ахилия (пищеварительная несостоятельность желудочного сока), атрофия слизистых ЖКТ, мышечная слабость, нарушения координации, походки, чувствительности. В некоторых случаях развиваются энкопрез и энурез. При длительной анемии дегенеративно-дистрофические процессы поражают миокард, обнаруживается демиелинизация нейронных оболочек. Выраженные нарушения наблюдаются со стороны ЦНС – от депрессивной подавленности до галлюцинаторно-бредовых психозов и деменции. Повышается онкологический риск на фоне атрофических и воспалительных процессов.
Диагностика
Быстрое и доказательное установление точного диагноза требует от врача высокой квалификации, большого опыта, а также постоянной настороженности в отношении гиповитаминозов. Подозрение на анемию, вызванную дефицитом внутреннего фактора Касла (пернициозная форма) или алиментарным, пищевым фактором, вызывается сочетанием неспецифических и характерных симптомов на фоне сниженного гемоглобина в общеклиническом анализе крови. При наличии такого подозрения назначается батарея лабораторных анализов, производится инструментальное обследование органов ЖКТ (рентгенография, ФГДС, ирригография, УЗИ и др.); по мере необходимости к лечебно-диагностическому процессу привлекаются кардиолог, невролог и другие специалисты.
Лечение
Терапевтическая стратегия определяется установленной этиологией анемии. Обязательными являются нормализация рациона, специальная диета, интенсивное лечение основного заболевания (если оно есть). Заместительная терапия цианкобаламином должна тщательно рассчитываться с учетом всех индивидуальных особенностей случая. Иногда имеются показания к назначению гормональных средств. При развитии жизнеугрожающего состояния прибегают к гемотрансфузиям. Паллиативные меры принимаются в зависимости от конкретного симптомокомплекса. Категорически исключен алкоголь – безжалостный антагонист витаминов группы В.
При поздней диагностике, длительном течении и запоздалом начале терапии изменения со стороны нервной системы могут оказаться глубокими и необратимыми.
Некоторые больные получают поддерживающее лечение пожизненно. Необходим также регулярный онкоконтроль.
Мегалобластная анемия
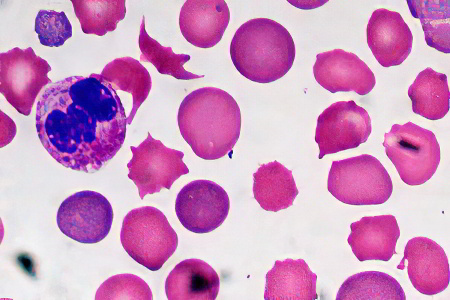
Мегалобластная анемия – это одна из разновидностей анемий, характеризующаяся нарушениями в системе кроветворения при которых в костном мозге начинают формироваться эритроциты, имеющие низменную структуру. Также мегалобластную анемию называют В12-дефицитной анемией.
В общей структуре анемий, мегалобластная анемия встречается в 9-12% случаев. Она с одинаковой частотой развивается как у мужчин, так и у женщин, но люди пожилого возраста страдают от патологии чаще.
Без лечения мегалобластная анемия будет прогрессировать и приведет к серьезным последствиям для здоровья человека.
Причины мегалобластной анемии
Развивается мегалобластная анемия по причине нехватке в организме фолиевой кислоты (витамин В9) и витамина В12 (цианокобаламин).
Привести к снижению уровня витамина В9 способны следующие факторы:
Погрешности в питании, когда человек резко ограничивает себя в пище.
Нарушение всасывания витамина В9 в кишечнике. Это происходит при различных патологиях органов пищеварительного тракта, например, энтерит, колит, целиакия.
Перенесенная резекция желудка или кишечника.
Определенные периоды в жизни человека, когда потребность в фолиевой кислоте резко возрастает, например, период вынашивания плода и период грудного вскармливания.
Некоторые разновидности гемолитических анемий.
Паразитарные инвазии, в частности, дифиллоботриоз.
Проведение внепочечного очищения крови.
Патологии печени: гепатит и цирроз.
Воспаление поджелудочной железы хронического течения.
Прием некоторых лекарственных препаратов: оральных гормональных контрацептивов, противосудорожных средств и пр.
Дефицит витамина В12 в организме может развиваться по следующим причинам:
Отказ от пищи животного происхождения и приверженность вегетарианству.
Онкологическое поражение желудочной стенки или наличие в желудке полипов.
Перенесенная резекция желудка и тонкого кишечника.
Аденома поджелудочной железы ульцерогенная.
Вынашивание ребенка и кормление его грудью.
Патологии печени: гепатиты и цирроз.
Дефицит транскобаламина II.
Витамин В12 и витамин В9 принимают непосредственное участие в процессе формирования ДНК и РНК человека, причем в первую очередь будут страдать клетки красного костного мозга и слизистых оболочек органов пищеварительной системы. Именно они в организме делятся быстрее остальных. Клетки-предшественники эритроцитов при такой патологии не в состоянии совершить полноценный переход к более зрелой форме. При этом они не погибают, их цитоплазма продолжает расти и развиваться. Как итог, в крови начинают циркулировать крупные неполноценные эритроциты, которые специалисты называют мегалобластами.
Витамин В12 в организм попадает вместе с пищей. Его основным источником являются продукты животного происхождения. В желудке он вступает во взаимодействие с особым веществом, которое называется гастромукопротеин. С ним витамин В12 образует комплексное соединение и в такой связке проникает в тонкую кишку, где всасывается в кровь. Каждый день здоровый человек должен получать от 3 до 7 мкг витамина В12. В печени, в норме, его содержится от 3 до 5 мг – это депо цианокобаламина. Фолиевой кислоты в сутки организм должен получать больше – около 100 мкг. Каждый день (при стандартном рационе) человек употребляет от 300 до 750 мкг фолиевой кислоты. В депо организма содержится около 5-10 мг этого вещества.
Витамин В12 в своем составе содержит 2 кофермента. Если наблюдается дефицит первого кофермента, то ДНК не в состоянии нормально формироваться, что приводит к сбою в выработке эритроидных клеток и появлению в крови мегалобластов. Также страдает процесс синтеза лейкоцитов и тромбоцитов, но не в такой мере, как эритроцитов.
Кроме того, нехватка первого кофермента не дает организму продуцировать аминокислоту (метионин), которая входит в состав миелиновых оболочек, покрывающих нервные стволы и клети. Поэтому нарушается работа нервной системы в целом.
Дефицит второго кофермента, входящего в состав витамина В12, приводит к тому, что в организме нарушается метаболизм жирных кислот. В нем начинают скапливаться токсины, которые поражают клетки спинного мозга. Эта патология носит название фуникулярный миелоз.
Симптомы мегалобластной анемии

Чаще всего мегалобластная анемия развивается по причине нехватки в организме именно витамина В12. Все симптомы этого нарушения объединены в четыре больших группы:
Отсутствие желания принимать пищу.
Отвращение к мясным блюдам.
Болезненные ощущения в области языка, искажение вкуса. Язык может стать яркого цвета, покрыться блестящей пленкой (атрофический глоссит Гюнтера).
Жалобы на тошноту, которая периодически может заканчиваться рвотой.
Расстройства чувствительности в виде «ползания мурашек по коже», покалывания кожи и пр.
Ощущение холода в конечностях, ухудшение их чувствительности.
Изменения в походке человека.
Снижение мышечной силы, а при тяжелом течении анемии у пациента развивается паралич.
Ощущение постоянной слабости.
Появление одышки. Сперва она возникает на фоне физической активности, а затем начинает беспокоить, даже когда человек отдыхает.
Болезненные ощущения в груди (болит сердце).
Кожные покровы становятся неестественно бледными, либо даже желтушными.
У человека усиливается раздражительность, он становится очень нервным.
Возможно возникновение галлюцинаций.
Периодически возникают судороги.
Умственные способности ухудшаются.
В начале развития анемии человек может не предъявлять каких-либо жалоб, так как патологические симптомы в этот период будут отсутствовать. Возможно незначительное ухудшение самочувствия, усталость и слабая диспепсия. Как правило, в этот период к врачам пациенты не обращаются. Хотя уже в это время достаточно сделать анализ крови, чтобы выявить развивающуюся анемию.
По мере прогрессирования заболевания симптомы начинают набирать силу. Если у человека уже имеются какие-либо патологии хронического течения, то их клиника будет усугубляться. Например, это справедливо в отношении стенокардии и аритмии. Также на ногах и руках, а еще на лице появляются отеки.
В пожилом возрасте анемия чаще всего имеет скрытое течение. Пациенты не указывают врачу на свое плохое самочувствие, что затрудняет диагностику.
Как обнаружить мегалобластную анемию?

Поиск верного диагноза начинается со сбора анамнеза и выслушивания жалоб пациента. Заподозрить анемию опытный врач может уже на этом этапе.
Осмотр пациента включает в себя следующие шаги:
Осмотр кожных покровов: они бледные, иногда с желтоватым оттенком («пергаментная кожа»).
Язык красный и блестящий, болезненный и слегка припухший.
При выслушивании сердцебиения диагностируются систолические шумы и тахикардия.
Во время прощупывания брюшины пальпируется увеличенная в размерах селезенка.
Также имеются признаки фуникулярного миелоза.
Следующим этапом диагностики является сдача крови на клинический анализ. В результатах исследования будет обнаружено уменьшение численности эритроцитов и гемоглобина, цветовой показатель крови превышает отметку 1,1. Иногда анемия сопровождается тромбопенией и лейкопенией. Также в крови визуализируются макроциты и мегалобласты. Клетки крови изменяют свою нормальную форму и размер. Еще один признак мегалобластной анемии – это наличие в крови колец Кеббота и телец Жолли. Уровень ретикулоцитов понижен.
Также наблюдается дефицит фолиевой кислоты и витамина В12 в сывороточной части крови. Показатели сывороточного железа остаются в пределах нормы, либо повышаются, что обуславливается ускоренным разрушением эритроцитов. Это факт также провоцирует скачок билирубина в крови.
Изучение костного мозга, который добывают путем выполнения стернальной пункции, позволяет уточнить диагноз. Исследование необходимо проводить заранее, то есть перед началом лечения. Дело в том, что прием витамина В12 уже через 1-2 суток вернет состав костного мозга в норму, а признаки мегалобластной анемии будут купированы.
У подавляющей части пациентов диагностируется поражение слизистых оболочек органов пищеварительной системы с их атрофическими изменениями. В желудке снижается выработка соляной кислоты.
Таким образом, диагностика мегалобластной анемии состоит из 3 основных этапов:
Забор крови на общий анализ.
Выполнение пункции костного мозга.
Сбор анамнеза и изучение состояния органов пищеварительной системы, в том числе, печени, селезенки и пр.
Обязательно нужно исключить факт наличия у пациента паразитарной инвазии.
Как лечить?
Лечение должно базироваться на причинах, приведших к развитию анемии. Возможно потребуется прием противопаразитарных препаратов, устранение полипов или иных новообразований органов пищеварительной системы, лечение болезней кишечника, помещение пациента в наркологическую клинику, если он страдает от алкогольной зависимости и пр.
Обязательно нужно откорректировать рацион больного. В его меню необходимо ввести мясо, печень, кисломолочные продукты, свежие овощи и фрукты.
Для ликвидации дефицита витамина В12 возможно внутримышечное или внутривенное введение цианокобаламина. В сутки может быть назначено от 200 до 1000 мкг препарата, что зависит от степени тяжести анемии.
После того как показатели крови придут в норму, дозировка лекарственного средства может быть уменьшена, либо сокращается кратность постанови инъекций. То есть вводят препарат 1 раз в 2 суток, а затем 2 раза в 7 дней.
Улучшение наступает уже спустя неделю от начала лечения, что характеризуется развитием ретикулоцитарного криза. В крови на 2-3% повышается уровень молодых эритроцитов. На эффективность проводимой терапии указывает нормализация показателей крови.
Иногда прием витамина В12 назначают на всю оставшуюся жизнь, например, при анемии Аддисона-Бирмера. При фуникулярном миелозе требуется ежедневно вводить пациенту от 800 до 100 мг цианокобаламина. Уменьшить дозировку препарата можно будет лишь после того, как удастся полностью избавить пациента от неврологической симптоматики.
Иногда мегалобластная анемия протекает очень тяжело, а сам больной может впасть в кому. В этом случае ему требуется переливание эритроцитарной массы.
Когда основной для развития анемии являются аутоиммунные заболевания, пациенту требуется введение глюкокортикостероидов. Дозировка лекарственного средства должна быть минимальной, а курс лечения непродолжительным.
При фолиеводефицитной анемии назначают прием Фолиевой кислоты. Суточная доза составляет от 1 до 5 мг лекарственного средства, в зависимости от тяжести течения болезни. После того, как все симптомы анемии будут купированы, потребуется курсовой прием фолиевой кислоты, чтобы не допустить повторного возникновения болезни. Но дозу препарата следует уменьшить.
Профилактика и прогноз

Чтобы не допустить развития анемии, необходимо соблюдать следующие рекомендации:
Правильно питаться, употребляя в пищу продукты, богатые витамином В9 и В12.
Вести здоровый образ жизни, отказаться от алкоголизма.
Не допускать ситуаций, которые могли бы привести к заражению паразитами.
Вовремя лечить все заболевания органов пищеварительной системы.
Что касается прогноза, то при своевременной терапии он благоприятный и от анемии удается полностью избавиться.
Какой врач лечит мегалобластную анемию?
При появлении первых признаков анемии следует обратиться к участковому терапевту. Если врач выявит подобное нарушение, то он перенаправит пациента к гематологу, который назначит лечение. Возможна консультация у узких специалистов, среди которых: невролог, инфекционист, гепатолог, гастроэнтеролог. Для подбора адекватной диеты следует посетить диетолога.

Автор статьи: Шутов Максим Евгеньевич | Гематолог
Образование: В 2013 году закончен Курский государственный медицинский университет и получен диплом «Лечебное дело». Спустя 2 года окончена ординатура по специальности «Онкология». В 2016 году пройдена аспирантура в Национальном медико-хирургическом центре имени Н. И. Пирогова.
Наши авторы
Ошибки диагностики и лечения мегалобластных анемий
Meгалобластоз — понятие универсальное, нарушение созревания ядра наблюдается во всех быстро делящихся клетках. В основе патогенеза лежит нарушение синтеза ДНК. В статье рассматриваются патофизиология, этиология, клиника и лечение мегалобластных анемий. Рассматриваются частые ошибки.
Ключевые слова: мегалобластные анемии, мегалобластоз, кобаламин, фолат, гиперсегментированные нейтрофилы, макроовалоциты.
А.V. KOSTERINA, А.R. AKHMADEEV
Kazan State Medical University
Republican Clinical Hospital of the Ministry of Health of the Republic of Tatarstan, Kazan
Diagnostic and treatment failures of megaloblastic anemia
Megaloblastosis is a universal concept, the dysmaturity of nucleus is observed in all rapidly cycling cells. Pathogenesis is based on a violation of DNA synthesis. The article discusses the pathophysiology, etiology, clinical picture and treatment of megaloblastic anemia. Common mistakes are discussed.
Key words: megaloblastic anemia, megaloblastosis, cobalamin, folate, hyperlobated neutrophils, macroovalocytes.
Наиболее часто встречающиеся ошибки при лечении анемического синдрома — неоправданное назначение препаратов железа, цианокобаламина и фолиевой кислоты [1]. Мы остановимся на ошибках диагностики и лечения мегалобластных анемий.
Мегалобластные анемии — гетерогенная группа нарушений, имеющих общие морфологические особенности. Meгалобластоз — понятие универсальное, нарушение созревания ядра наблюдается во всех быстро делящихся клетках организма, например, клетках слизистой ЖКТ или слизистой матки [2].
Этиология мегалобластной анемии разнообразна. Самые частые причины — дефициты фолата и кобаламина (витамина B12). Из причин дефицита кобаламина наиболее частые — пернициозная анемия (ПА), нарушение всасывания кобаламина в терминальном отделе подвздошной кишки и влияние препаратов (цитостатики). Дефицит фолата бывает чаще из-за неправильного питания (отсутствие сырых овощей в диете), при беременности и при применении препаратов с антифолатным действием (метотрексат, 6-меркаптопурин, антиретровирусные препараты и др.). Миелопролиферативные заболевания и вирусные инфекции (например, ВИЧ), нарушая синтез ДНК, также могут привести к мегалобластозу. Многие химиотерапевтические, противосудорожные препараты (фенитоин), противозачаточные средства могут вызывать мегалобластоз.
Молекулярная основа мегалобластоза — нарушения синтеза и сборки ДНК. Несмотря на всю имеющуюся информацию, биохимические пути полностью не поняты. Это особенно относится к кобаламин-связанной нейропатии, которая может существовать независимо от гематологических изменений. Недавние исследования доказали, что дефицит фолиевой кислоты также может вызывать неврологические нарушения [3].
Признак мегалобластной анемии — неэффективный эритропоэз, о чем свидетельствует эритроидная гиперплазия в костном мозге, уменьшение ретикулоцитов на периферии, повышение ЛДГ и непрямого билирубина. Данные лабораторные показатели — следствие внутрикостного разрушения хрупких и неправильно сформированных эритроидных предшественников.
Люди не могут синтезировать кобаламин и фолиевую кислоту, поэтому зависят от поступления этих веществ с пищей. Кобаламин связывается с внутренним фактором (ВФ), и всасывается в терминальном отделе подвздошной кишки. После всасывания кобаламин присоединяется к другому белку, транскобаламину II, и транспортируется к участкам хранения. Нарушения на любом этапе транспорта могут привести к дефициту. В организме содержится значительное количество кобаламина; это объясняет, почему протекают годы, прежде развивается его дефицит [3].
Хотя всасывание и транспорт фолиевой кислоты сложны, на этих этапах редко возникают нарушения, чаще дефицит вызван диетическим недостатком. Запас фолата в организме небольшой, поэтому дефицит может развиться в течение нескольких месяцев после прекращения приема фолата с пищей. Дефицит фолиевой кислоты может возникать у пациентов с целиакией, болезнью Крона, лимфомой тонкого кишечника, амилоидозом, поражением тонкого кишечника при системной склеродермии.
В последнее время стали выделять связанную с пищей мальабсорбцию кобаламина (СПМК). При этом состоянии кобаламин в достаточном количестве поступает с пищей в желудок, но отделение его от пищи и всасывание не происходят. Нужно заметить, что, согласно литературным данным, СПМК встречается намного чаще, чем диагностируется. Причина низкой диагностики в отсутствии чувствительного и специфичного теста для этой патологии. В США до 2003 года практиковался тест Шиллинга, но из-за высокой стоимости и отказа страховых компаний оплачивать его от этого теста отказались.
В тесте Шиллинга сначала кобаламин изолированно принимался на голодный желудок, затем кобаламин вместе с ВФ, и, если требовалось исключить СПМК, все смешивалось вместе с пищей. Отсутствие всасывания до добавления ВФ означает пернициозную анемию (ПА), нарушения всасывания после добавления ВФ — заболевания тонкого кишечника, отсутствие всасывания кобаламина, смешанного с пищей, — СПМК.
При СПМК клинические проявления дефицита кобаламина развиваются намного медленнее, чем при пернициозной анемии, так как всасывание кобаламина из желчи сохраняется.
Ряд авторов указывают на положительную клиническую динамику СПМК после лечения антибиотиками, направленными против H. рylori [4]. Этот вид СПМК считают связанным с H. рylori-ассоциированным гастритом, но не надо забывать, что большинство пациентов, инфицированных H. рylori, не имеют клинических и биохимических проявлений дефицита кобаламина. Данные требует дальнейшего изучения [5].
Частота ПА — 0,25—0,5 случая на 1000 человек старше 60 лет. Другие формы мегалобластоза редки. Люди белой расы болеют ПА в несколько раз чаще, чем люди азиатской и афроамериканской расы.
Жалобы при мегалобластной анемии, на которые редко обращают внимание:
— боли в языке и ротовой полости;
— изменение походки, потеря памяти, парестезии в пальцах рук и, прежде всего, ног;
— обращения к психиатру;
Особенности питания и предыдущее лечение требуют детализации при сборе анамнеза. Диетический недостаток — самая частая причина дефицита фолата [6]. Типичный пациент — пожилой человек, диета которого бедна сырыми овощами и фруктами, или который готовит пищу в большом количестве воды с чрезмерной высокой температурой. Также важно регистрировать все препараты, которые принимает пациент (метотрексат, 6-меркаптопурин, антиретровирусные препараты).
ПА — аутоиммунное заболевание, может сочетаться с другими аутоиммунными заболеваниями (аутоиммунный тиреоидит, сахарный диабет I типа, болезнь Аддисона, гипопаратиреоидизм, аутоиммунная гемолитическая анемия).
Оперированный желудок или тонкий кишечник предрасполагают к развитию дефицита кобаламина. При тотальной гастрэктомии 3—5 лет, при частичной гастрэктомии приблизительно 12 лет проходят до развития дефицита кобаламина. После хирургического вмешательства возможно развитие синдрома слепой петли.
Синдром Золлингера-Эллисона может вызвать мегалобластоз, т.к. избыток соляной кислоты делает невозможным активацию панкреатических ферментов, действие которых необходимо, чтобы кобаламин освободить от связи с r-фактором (содержится в слюне) до того, как он соединился с ВФ. Разделка и/или поедание сырой рыбы в прошлом требует исключения инвазии солитером (лентецом широким).
Пациентам с псориазом и экфолиативным дерматитом фолат требуется дополнительно из-за повышенного слущивания эпидермальных клеток. При полном парентеральном питании и гемодиализе развивается дефицит фолата, потому что фолат теряется в жидкости диализата. Известно, что мегалобластоз наблюдается у людей с алкоголизмом из-за дефицита фолата вследствие конкуренции алкогольдегидрогеназы с фолатом. Дефицит фолата развивается у младенцев при вскармливании козьим молоком (низкое содержание фолата) и некоторыми синтетическими смесями.
Объективные данные. Кроме симптомов, относящихся к анемическому синдрому (одышка, тахикардия, слабость и др.), могут наблюдаться симптомы, характерные только для мегалобластных анемий. Кожа бледная с лимонно-желтым оттенком из-за сочетания снижения гемоглобина с увеличением непрямого билирубина, возможна гиперпигментация кожи и депигментация волос из-за увеличенного синтеза меланина. Характерны гладкий язык из-за сглаживания сосочков, явления глоссита. У ряда больных наблюдается гепатолиенальный синдром.
Психоневрологические признаки дефицита кобаламина: периферическая нейропатия, неправильная походка, потеря баланса, потеря проприорецепции и вибрации, слепота из-за атрофии зрительного нерва, потеря памяти, психические нарушения (депрессии). Психоневрологические осложнения дефицита фолата обычно ограничиваются раздражительностью.
Пациенты с ПА могут иметь признаки других аутоиммунных нарушений (аутоиммунный тиреоидит, сахарный диабет I типа, болезнь Аддисона, гипопаратиреоидизм, аутоиммунная гемолитическая анемия).
Лабораторные данные. Эритроциты — больше по размеру, овальные и имеют большее ядро по отношению к цитоплазме по сравнению с нормальными эритроцитами. Нейтрофилы — гиперсегментированые (5 и больше долек в ядре), в мегалобластах костного мозга отстает созревание ядра на фоне нормально созревающей цитоплазмы. Обычно наблюдается макроцитарная анемия, тромбоцитопения, снижение ретикулоцитов. Средний объем эритроцита от 100-150 fL и более.
Макроцитоз может быть замаскирован наличием таласемии или дефицита железа (анемия станет нормоцитарной). Однако гиперсегментация нейтрофилов может сохраниться.
ЛДГ очень удобный тест для определения гемолиза, снижение ЛДГ говорит о положительной динамике и эффекте терапии. Отношение фракций ЛДГ 1 (LDH1) и ЛДГ 2 (LDH2) повышено, с LDH1/ LDH2 ≥1. Обязательно нужно исследовать железо сыворотки и ферритин, так как лечение мегалобластой анемии замедлится из-за недостатка железа.
Исследование уровня кобаламина крови должно быть проведено как можно раньше; если это невозможно по техническим причинам, сыворотку нужно заморозить до момента проведения теста. Ложно завышенный уровень кобаламина бывает при миелопролиферативных заболеваниях, врожденных аномалиях обмена кобаламина, после использования закиси азота. Ложно низкие значения кобаламина бывают при дефиците фолата или железа, у вегетарианцев, при употреблении высоких дозах аскорбиновой кислоты, у беременных женщин, при врожденном дефиците траскобаламина I.
Также нужно определять уровень фолиевой кислоты, так как низкий уровень фолата снижает уровень кобаламина. Уровни метилмалоновой кислоты и гомоцистеина в сыворотке повышаются при дефиците кобаламина, ложно завышенные значения этих показателей появляются при почечной недостаточности.
Антитела к париетальным клеткам желудка определяют редко, тест положителен у 90 % пациентов с ПА. Однако, этот тест положителен и при других аутоиммунных нарушениях (тест с хорошей специфичностью, но низкой чувствительностью).
Антитела к ВФ определяют крайне редко. Используется измерение гастрина и пепсиногена I (тест с хорошей чувствительностью, но низкой специфичностью).
Исследование костного мозга лучше проводить на ранних этапах диагностики для исключения миелодисплазии, и до назначения лечения, так как костный мозг меняется в течение 24 часов от начала лечения. Костный мозг гиперклеточен. Увеличение эритроидного ростка проявляется изменением миелоидно-эритроидного отношения. Эритроидные предшественники при мегалобластическом кроветворении больше по размеру и имеют отстающее в созревании ядро. Цитоплазматическое созревание нормальное, могут наблюдаться тельца Хауэлл-Джолли в цитоплазме [7].
Дефицит кобаламина редко требует немедленного лечения и позволяет провести в течение нескольких дней диагностические исследования. Длительно, месяцами, существующая анемия приводит к развитию компенсаторных механизмов. Даже пожилые пациенты с гемоглобином 50 г/л не тяжело переносят это состояние. Немедленного назначения кобаламина парентерально требуют тяжелые неврологические нарушения (выраженный сенсорный дефицит и нарушения походки), т.к. возможны необратимые изменения. Немедленное переливание эритроцитарной массы требуется только при симптомах ишемии миокарда, головного мозга или угрозе развития сердечной недостаточности. Необоснованное переливание эритроцитарной массы может усилить гемолиз, так часто наблюдающийся при В12-дефицитной анемии.
Российские рекомендации по лечению В12-дефицитной анемии: ежедневное введение цианокоболамина в дозе 500—1000 мкг внутримышечно 1 раз в сутки в течение 3 дней, затем по 500 мкг ежедневно, после нормализации картины крови препарат вводят 1 раз в месяц 500 мкг с профилактической целью.
Американские источники рекомендуют следующее: при тяжелых формах цианокобаламин (1000 мкг) назначается парентерально ежедневно в течение 2 недель, затем 1 раз в неделю до нормализации гематокрита, затем 1 раз в месяц пожизненно. Эта доза является большой, но это оправдано в большинстве случаев, т.к. 250 мг откладывается в депо. Пациенты с неврологическими осложнениями должны получить цианкобаламин в дозе 1000 мкг (иногда больше) каждый день в течение 2 недель, затем 1 раз каждые 2 недели в течение 6 месяцев, и ежемесячно — всю жизнь.
Пероральную форму кобаламина (1000 мкг) можно назначать пациентам с гемофилией. Можно начинать лечение с парентерального кобаламина с переходом на пероральный [8].
Терапия кобаламином иногда требуется у пациентов с пограничным значением кобаламина в сыворотке и незначительными неврологическими нарушениями. Таким пациентам достаточно 50 мкг перорального цианокобаламина ежедневно. При использовании инъекционных форм кобаламина чаще наблюдаются аллергические реакции, требующие назначения антигистаминных или стероидных препаратов.
Ряд авторов рекомендуют введение препаратов калия во время лечения кобаламином, так как калий потребляется вновь образованными эритроцитам и возможно развитие гипокалиемии. Трансфузии жидкостей следует ограничить во время введения кобаламина.
Рекомендованные в настоящее время добавки фолиевой кислоты беременным и пожилым привели к снижению дефицита фолиевой кислоты. Профилактическую дозу фолата (1 мг/день) рекомендуется назначать во время беременности и перинатального периода, при хроническом гемолизе.
В настоящее время добавление фолиевой кислоты рекомендуется для профилактики атеросклероза и тромбоэмболических событий, так как фолиевая кислота снижает уровень гомоцистеина крови [9]. Также доказано влияние фолиевой кислоты на женскую и мужскую репродуктивную функцию. Фолат (1—5 мг) назначают перорально.
Ни в коем случае не рекомендуется назначать терапевтическую дозу (1—5 мг/день) фолиевой кислоты, если причина мегалобластоза не ясна. Предлагается назначать физиологическую дозу фолата 100—400 мкг, так как дефицит кобаламина не отреагирует на такую дозу, но она приведет к положительной динамике симптомов у пациентов с дефицитом фолата.
Консультации специалистов. Консультация гематолога — если причина макроцитоза не ясна, если нет ответа на терапию, при наличии неврологических осложнений. Консультация невропатолога — при наличии неврологических осложнений. Консультация гастроэнтеролога — для исключения ПА, синдрома слепой петли. Диагноз пернициозной анемии требует периодического онкологического обследования пациента из-за повышенного риска развития опухолей желудка.
Диета. Продукты, богатые фолатом: спаржа, брокколи, шпинат, салат, лимоны, бананы, дыня, печень, и грибы. Чтобы предотвращать потерю фолата, пищевые продукты не должны быть приготовлены в большом количестве воды с длительным кипячением. Пациентам, придерживающимся вегетарианской диеты, для предотвращения дефицита кобаламина рекомендовать включать в рацион молочные продукты и яйца.
Несмотря на появления чувства прилива сил в первые 24 часа после введения кобаламина, гематологические изменения начинают исчезать только спустя несколько дней и первым объективным критерием является повышение уровня ретикулоцитов в течение 3—5 дней с пиком через 4—10 дней. При отсутствии повышения уровня ретикулоцитов нужно предположить неправильно поставленный диагноз или сопутствующий дефицит железа.
Повышенные уровни ЛДГ и непрямого билирубина быстро снижаются. Уровень гемоглобина должен повышаться приблизительно на 1 г/л/неделю. Если гемоглобин не повышается приблизительно с такой скоростью и не достигает нормальных цифр в течение 2 месяцев, существует другая причина анемии.
Лейкоциты и тромбоциты обычно восстанавливаются в течение дней нескольких дней от начала терапии, а гиперсегментированные нейтрофилы могут сохраниться в течение 10—14 дней.
Снижение уровня ЛДГ и ретикулоцитоз — превосходные параметры эффективности терапии на ранних этапах. Конечным критерием эффективности лечения является нормализация среднего объема эритроцита (MCV) к 8-й неделе лечения.
Неврологические нарушения начинают меняться через неделю и полностью исчезают через 6—12 недель от начала лечения. К сожалению, обратимость неврологических нарушений не всегда полная. В случае замедления положительной неврологической динамики большинство авторов предлагает применять большие дозы кобаламина.
Пациентам нужно начинать реабилитацию, в частности походки, нарушений мочеиспускания и дефекации. При отсутствии положительной неврологической динамики необходимо измерить уровень фолата крови. Необратимыми считаются неврологические нарушения, не имеющие положительной динамики в течение 6 месяцев. Пациенты после гастрэктомии должны получить пожизненно ежемесячно 200—500 мкг цианокобаламина внутримышечно.
1. Альпидовский В. К. Анемии: стратегия и тактика диагностического поиска. — Consilium medicum. — 2002. — Том 2, № 6.
2. Carmel R. Efficacy and safety of fortification and supplementation with vitamin B12: biochemical and physiologic effects. — Food Nutr Bull.— 2008. — V. 29 (suppl.). — P. S177—S187.
3. Chan C. W. J., Liu S. Y. H., Kho C. S. B. et al. Diagnostic clues to megaloblastic anaemia without macrocytosis. — Int J Lab Hematol. — 2007. — V. 29. — P. 163—171.
4. Dierkes J., Ebert M., Malfertheiner P., Luley C. Helicobacter pylori infection, vitamin B12 and homocysteine: a review. — Dig Dis. — 2003. — V. 21. — P. 237—244.
5.Carmel R. The disappearance of cobalamin absorption testing: a critical diagnostic loss.— J Nutr. — 2007. — V. 137. — P. 2481—2484.
6. Antony A. C. Vegetarianism and vitamin B12 (cobalamin) deficiency. — Am J Clin Nutr. — 2003. — V. 78. — P. 3—6.
7. Reynolds E. Vitamin B12, folic acid, and the nervous system. — Lancet Neurol. — 2006. — V. 5. — P. 949—960.
8. Carmel R., Sarrai M. Diagnosis and management of clinical and subclinical cobalamin deficiency: advances and controversies. — Curr Hematol Rep. — 2006. — V. 5. — P. 23—33.
9. Carmel R., Green R., Rosenblatt D. S., Watkins D. Update on cobalamin, folate, and homocysteine. — Hematology. — 2003. — P. 62—81.
Мегалобластные анемии: причины, симптомы, диагностика, лечение

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Мегалобластные анемии являются результатом дефицита витамина В12 и фолиевой кислоты. Неэффективный гемопоэз поражает все клеточные линии, но в особенности эритроидную. Диагноз базируется на общем анализе крови, мазке периферической крови, в которых определяется макроцитарная анемия с анизоцитозом и пойкилоцитозом, большие овальные эритроциты (макроовалоциты), гиперсегментация нейтрофилов и ретикулоцитопения. Лечение направлено на устранение основной причины.
Макроцитами называют увеличенные эритроциты (MCV > 95II). Макроцитарные эритроциты обнаруживаются при различных заболеваниях, многие из которых не связаны с мегалобластозом и развитием анемии. Макроцитоз может быть обусловлен мегалобластами или другими увеличенными эритроцитами. Мегалобласты – это большие ядросодержащие предшественники эритроцитов, содержащие неконденсированный хроматин. Мегалобластоз предваряет развитие макроцитарной анемии.

[1], [2], [3], [4], [5], [6], [7], [8]
Код по МКБ-10
Причины мегалобластной анемии
Наиболее частой причиной межобластного кроветворения является нарушение утилизации витамина В12 или фолиевой кислоты. Другими причинами являются употребление лекарственных препаратов (обычно цитостатических или иммунодепрессантов), нарушающих синтез ДНК, и реже метаболические заболевания. В некоторых случаях этиология мегалобластоза неизвестна.

[9], [10], [11], [12], [13], [14], [15], [16]
Патогенез
Мегалобластный тип кроветворения является результатом нарушения синтеза ДНК, приводя к появлению больших клеток с крупными ядрами. Во всех клеточных линиях имеет место нарушение созревания, при котором созревание цитоплазмы опережает созревание ядер, это приводит к появлению мегалобластов в костном мозге, прежде чем происходят изменения в крови. Нарушение гемопоэза вызывает костномозговую гибель клеток, делая эритропоэз неэффективным, и непрямую гипербилирубинемию и гиперурикемию. Поскольку нарушение созревания поражает все клеточные линии, определяется ретикулоцитопения, в более поздних стадиях лейкопения и тромбоцитопения. Большие овальные эритроциты (макроовалоциты) появляются в кровотоке. Характерны гиперсегментированные полиморфноядерные нейтрофилы, механизм образования которых неясен.

[17], [18], [19], [20], [21]
Симптомы мегалобластной анемии
Анемия развивается исподволь и может быть бессимптомной, пока не станет выраженной. Дефицит витамина В12 может приводить к манифестации неврологической симптоматики, включая периферическую нейропатию, деменцию и подострую комбинированную дегенерацию. Дефицит фолиевой кислоты может вызвать развитие диареи, глоссита, потери веса.
Большинство макроцитарных (MCV > 95 fl/клетку) анемий являются межобластными. Немегалобластный макроцитоз проявляется при различных клинических состояниях, не все из которых ясны. Анемия обычно развивается по механизмам, не зависящим от макро-цитоза. Макроцитоз, обусловленный избытком мембраны эритроцитов, проявляется у больных с хроническим заболеванием печени, при котором нарушается этерификация холестерина. Макроцитоз с MCV от 95 до 105 95А/клетку проявляется при хроническом алкоголизме с отсутствием дефицита фолиевой кислоты. Умерено выраженный макроцитоз встречается при апластической анемии, особенно в период восстановления. Макроцитоз типичен и для миелоидисплазии. Вследствие того что эритроциты модифицируют свою форму в селезенке после выхода из костного мозга, макроцитоз может наблюдаться после спленэктомии, хотя эти изменения не ассоциированы с анемией.
Немегалобластный макроцитоз подозревается у больных с макроцитарной анемией, у которых после проведения исследований исключен дефицит витамина В12 и фолиевой кислоты. Макроовалоциты в мазке периферической крови и повышение RDW, что является типичным для классической мегалобластной анемии, могут отсутствовать. Если немегалобластный макроцитоз необъясним клинически (например, при наличии апластической анемии, хроническом заболевании печени или употреблении алкоголя) или при подозрении на миелодиплазию, необходимы выполнение цитогенетических исследований и изучение костного мозга, чтобы исключить наличие миелодисплазии. При немегалобластном макроцитозе в костном мозге мегалобласты не определяются, но при миелодисплазии и выраженном поражении печени характерны мегалобластоидные предшественники эритроцитов с плотными конденсатами хроматина, которые отличаются от обычных тонких нитей, характерных для мегалобластных анемий.
Диагностика мегалобластной анемии
Наличие мегалобластной анемии предполагается у больных с анемией и макроцитарными индексами эритроцитов. Диагноз обычно базируется на исследовании мазка периферической крови. При полной картине анемии имеет место макроцитоз с MCV > 100fl. В мазке наблюдаются овалоцитоз, анизоцитоз и пойкилоцитоз. Значение разброса эритроцитов по объему (RDW) высокое. Часто встречаются тельца Хауэлла-Жолли (фрагменты ядер). Определяется ретикулоцитопения. Рано развивается гиперсегментация гранулоцитов, позже нейтропения. В тяжелых случаях часто встречается тромбоцитопения, а тромбоциты могут иметь отклонения в размерах и форме. В неясных случаях необходимо выполнить исследование костного мозга.

[22], [23], [24], [25], [26], [27], [28], [29], [30], [31], [32]
В12 дефицитная анемия. Клиническая картина и диагностика.
Неэффективный синтез ДНК в гемопоэтических клетках-предшественниках является основным механизмом, приводящим к мегалобластной анемии. Наиболее частыми причинами мегалобластной анемии являются дефицит витамина B12 или фолиевой кислоты. Неэффективный гемопоэз, являющийся результатом асинхронности между ядерным и цитоплазматическим развитием, наиболее очевиден на мазках аспирата костного мозга, окрашенных по Райту-Гимзе. Предшественники мегалобластных эритроидов крупнее нормальных, их ядра крупнее и кажутся незрелыми с зернистым хроматином. На начальных стадиях клеточной дифференцировки медленная конденсация хроматина приводит к образованию открытого решетчатого везикулярного ядра. На последующих этапах цитоплазмы увеличивается. количество предшественников мегалобластных эритроидов по отношению к размеру ядра. Предшественники гранулоцитов также обнаруживают ядерно-цитоплазматическую диссинхронию с развитием так называемых гигантских метамиелоцитов и полос, которые имеют характерное подковообразное ядро и открытый хроматин. На развитие мегакариоцитов также влияют аномальные большие полилобластные мегакариоциты с отсутствием цитоплазматических гранул. Соответствующие изменения в мазке крови включают анемию с овальными макроцитами, анизоцитоз, пойкилоцитоз, лейкопению с гиперсегментированными полиморфноядерными клетками и тромбоцитопению.
Патогенез мегалобластной анемии.
Дефицит фолиевой кислоты и витамина B12 – главные причины мегалобластной анемии во всем мире. В эпоху обогащения пищевых продуктов фолиевой кислотой наблюдается тенденция к снижению распространенности дефицита фолиевой кислоты в большинстве развитых стран. Классически при мегалобластозе в быстро делящихся гемопоэтических предшественниках наблюдается дефектный синтез ДНК. В меньшей степени РНК и синтез белка нарушены, и эти клетки, как правило, имеют больше цитоплазмы и РНК, чем их нормальные аналоги, что позволяет предположить, что компоненты цитоплазмы синтезируются быстрее, чем ДНК. Происходит удлинение S-фазы синтеза ДНК из-за задержки миграции вилки репликации ДНК и соединения фрагментов ДНК, синтезированных из отстающей цепи (фрагменты Окадзаки). Имеются данные, свидетельствующие о том, что из-за созревания ядра происходит остановка, несбалансированный рост клеток и нарушение деления клеток. Значительная потеря дефектных гематопоэтических предшественников происходит из-за апоптоза. Метаболическая взаимосвязь между фолатами и B12 участвует в развитии мегалобластной анемии, потому что B12 необходим для регенерации тетрагидрофолата (THF) посредством реакции метионинсинтазы, это необходимо для производства метилен-THF, который необходим для тимидина и, следовательно, для синтеза ДНК. Витамин B12 является кофактором как для цитоплазматической метионинсинтаза и митохондриальные l-метилмалонил-коферментные мутазные реакции.
Анемия развивается постепенно с достаточным временем для сердечно-легочной и интраэритроцитарной компенсации до появления симптомов. Симптомы обычно развиваются у пациентов с тяжелой анемией. Основные симптомы включают слабость, сердцебиение, утомляемость, головокружение и одышку, вызванные низким гематокритом. Желтуха может возникнуть в результате интрамедуллярного и внесосудистого гемолиза. Лейкопения или тромбоцитопения обычно присутствуют, но обычно не вызывают клинических опасений. При дефиците B12 часто возникают неврологические симптомы, а также вегетативные желудочно-кишечные расстройства. Неврологические симптомы возникают в результате симметричных парестезий, онемения и нарушения чувствительности к вибрации и позе, что приводит к нарушениям походки. При дефиците B12 могут быть церебральные проявления, включая спутанность сознания, паранойю, слабоумие и даже явный психоз.13 Другие сопутствующие симптомы, редко встречающиеся при дефиците витамина B12, включают генерализованную мальабсорбцию, вызванную мегалобластозом кишечника, бесплодием, глосситом и церебральным синдромом. венозный тромбоз.
Лабораторная диагностика В12 дефицитной анемии.
Подозрение на мегалобластную анемию основано на рассмотрении клинических признаков, описанных ранее, в сочетании с результатами анализа крови и исследования мазка крови, показывающего анемию и патологические показатели эритроцитов (средний корпускулярный объем [MCV], средний корпускулярный гемоглобин) вместе с анизоцитозом, пойкилоцитозом и гиперсегментированным нейтрофилезом. Однако наличие гиперсегментированных нейтрофилов не является диагностическим признаком мегалобластной анемии, поскольку они также могут встречаться при железодефицитной анемии. Таким образом, исследования дефицита железа также следует рассматривать в случаях мегалобластной анемии. Первоначальные тесты, которые следует выполнять для оценки мегалобластной анемии, – это измерение уровней витамина B12 и фолиевой кислоты в плазме или сыворотке, а также фолиевой кислоты в эритроцитах.
О дефиците B12 свидетельствует уровень B12 в организме менее 200 пг / мл. Однако уровни B12 могут быть низкими без основного дефицита из-за низкого уровня или отсутствия основной связывающий белок B12 плазмы, гаптокоррина, или может быть ложно нормальным у пациентов с пернициозной анемией, если они имеют повышенные уровни циркулирующих антител внутреннего фактора. Антитела к внутреннему фактору могут взаимодействовать со связующим веществом внутреннего фактора, которое используется в большинстве анализов B12. Пограничные уровни B12 (200–400 нг / л) следует отслеживать с измерением уровней метаболитов, которые увеличиваются при дефиците B12. Повышенное содержание метилмалоновой кислоты(MMA) считаются высокочувствительным и специфическим тестом для выявления дефицита B12, и, если уровень MMA не повышается, это свидетельствует о нормальном статусе витамина B12. Уровни MMA всегда снижаются вместе с витамином. Дефицит B12 также приводит к высокому уровню гомоцистеина в плазме. Однако это не является специфическим показателем дефицита B12, потому что высокий уровень гомоцистеина также вызван дефицитом фолиевой кислоты. Фракция B12 в циркуляции, которая связана с транспортным белком B12, транскобаламином, в отличие от Другой B12-связывающий белок плазмы, гаптокоррин, был предложен в качестве более надежного индикатора функционального статуса B12, поскольку он отвечает за клеточную доставку и поглощение витамина. Однако из-за проблем с другими индексами использовалась оценка статуса B12. Сама по себе была тенденция к комбинированию использования 2 или более аналитов, таких как общий B12, с транскобаламином или MMA. В последнее время использовался комбинированный индикатор статуса. Существует множество причин дефицита B12, и хорошее понимание физиологии абсорбции B12 необходимо для оценки нескольких возможных основных нарушений, которые могут привести к мегалобластной анемии с дефицитом B12. Полное и подробное рассмотрение причин дефицита B12 хорошо описано в других источниках. В общем, причины дефицита B12 можно разделить на желудочные и подвздошные, поскольку ключевые компоненты нормального пути абсорбции B12 требуют функционирования. желудок для производства внутреннего фактора белка и интактный рецептор кубилина для комплекса внутреннего фактора-B12 в терминальной части подвздошной кишки. Среди нескольких причин дефицита B12 выделяется злокачественная анемия, вызванная аутоиммунным разрушением кишечника. париетальные клетки желудка, вырабатывающие внутренний фактор. Наличие циркулирующих антител против внутреннего фактора l очень специфично для диагностики пернициозной анемии. Однако тест имеет низкую чувствительность и является положительным только у 60% пациентов с пернициозной анемией. Хронический атрофический гастрит, связанный с пернициозной анемией, может быть диагностирован с помощью эндоскопической биопсии, повышенного уровня гастрина в сыворотке крови натощак. , и снижение уровня сывороточного пепсиногена I.
54. Мегалобластные анемии: этиология, патогенез, клиника, классификация, диагностика, лечение.
Мегалобластные анемии (МА) – группа анемий, основной причиной которых является дефицит фолиевой кислоты и витамина В12 и связанное с этим нарушение синтеза ДНК (при этом страдают прежде всего быстро обновляющиеся ткани – кроветворная и эпителий ЖКТ).
Морфологически при МА деление клеток замедляется, цитоплазма созревает нормально, в результате клетки становятся крупными, содержание РНК превышает ДНК; эритропоэз неэффективный, т.к. на уровне костного мозга образуются мегалобласты – предшественники эритроцитов, разрушающиеся в самом костном мозге.
Классификация мегалобластных анемий:
а) В12-дефицитная анемия
б) Фолиеводефитиная анемия
в) МА, обусловленная наследственным дефицитом ферментов, участвующих в синтезе пуриновых и пиримидиновых оснований (дигидрофолиевой редуктазы, формиминотрансферазы и др.)
г) МА, поддающаяся лечению витамином В1 (врожденное аутосомно-рециссивное заболевание)
д) МА, обусловленная дефицитов витамина С (он участвует в метаболизме фолиевой кислоты)
е) острая мегалобластная болезнь (быстрое развитие МА вследствие действия различных причин – закиси азота, гемодиализа, длительного парентерального питания и др.)
Этиология мегалобластных анемий:
а) недостаточное поступление его с пищей
б) нарушение его всасывания при недостатке внутреннего фактора Касла (на уровне желудка), поражении дистальных отделов ileum, конкурентном поглощении витамина В12 при дифиллоботриозе, применении некоторых лекарственных средств (аминосалициловая кислота, неомицин)
2. Причины дефицита фолиевой кислоты:
а) недостаточное поступление с пищей (особенно у алкоголиков, подростков, грудных детей)
б) период повышенной потребности в фолиевой кислоте (беременность, грудной возраст, злокачественные опухоли, гемолитическая анемия, гемодиализ)
в) нарушение всасывания (болезни тонкого кишечника: целиакия, спру; применение некоторых ЛС: барбитураты, фенитоин)
г) нарушения метаболизма фолиевой кислоты (применение ингибиторов дигидрофолатредуктазы – метотрексата, триметоприма; алкоголь; недостаточность дигидрофолатредуктазы) и др.
Патогенез мегалобластных анемий:
Фолиевая (птероилглутаминовая) кислота – источник для человека – зеленые овощи и фрукты, минимальная потребность – 50 мкг/сут (при беременности увеличивается в несколько раз), резерв в организме 5-20 мг (половина резерва содержится в печени); в пище находится в конъюгированной форме в виде полиглютамата; основная функция – перенос метильной или формильной группы от одного вещества к другому.
Метаболизм фолиевой кислоты: полиглютамат + γ-глютамилгидролаза в просвете кишечника моноглютамат всасывание в проксимальном отделе тонкой кишки попадание с помощью переносчика в клетку потеря метильной группы (при участии витамина В12) повторное образование полиглютамата использование на нужды клетки.
При дефиците фолиевой кислоты нарушается синтез ДНК в кроветворных клетках из-за нарушения синтеза пуриновых и пиримидиновых оснований.
Витамин В12 (кобаламин) – источник для человека – продукты животного происхождения (мясо, молоко, яичные желтки); минимальная потребность – 2,5 мкг/сут, резерв в организме: 2 мг в печени + 2 мг в других тканях (поэтому дефицит развивается лишь через 3-6 лет после прекращения поступления в организм);
Метаболизм кобаламина: высвобождение кобаламина из пищи в желудке + желудочный R-белок комплекс В12+R-белок поступает в ДПК соединение с внутренним фактором Касла (вырабатывается париетальными клетками желудка) расщепление образовавшегося комплекса в энтероцитах концевого отдела подвздошной кишки связь кобаламина с транскобаламином II (переносчиком) перенос кровью к костному мозгу и печени.
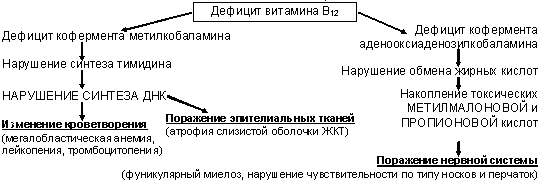
Атрофия желудка с нарушением образования внутреннего фактора Касла и развитием МА – болезнь Адиссона-Бирмера (пернициозная анемия, в 60% при ней обнаруживают АТ к париетальным клеткам желудка или к внутреннему фактору Касла)
Клиническая картина В12-дефицитной анемии:
а) поражение пищеварительной системы – чаще всего самые ранние признаки заболевания:
– снижение или отсутствие аппетита, ощущение тяжести и полноты в подложечной области после еды, отрыжка съеденной пищей и воздухом, боль и жжение в языке, в области десен, губ, иногда в области прямой кишки (из-за глоссита, атрофического гастрита и атрофии слизистой кишечника)
– воспалительно-атрофические изменения слизистой полости рта и языка (слизистая рта бледная, с признаками афтозного стоматита; гладкий «лакированный» язык с атрофированными сосочками, потрескавшийся, с участками воспаления ярко-красного цвета, иногда с изъязвлениями – глоссит Hunter)
– пальпаторно – неинтенсивная боль в эпигастральной области, иногда – гепатоспленомегалия
б) поражение кроветворной системы – чаще всего ведущие признаки заболевания:
– общеанемический синдром (как при ЖДА)
– кожа бледная, часто с лимонно-желтым оттенком (в связи с гипербилирубинемией из-за гемолиза), легкая иктеричность склер
– несколько одутловатое лицо, часто – пастозность в области голеней и стоп
– синдром миокардиодистрофии (тахикардия, экстрасистолия, небольшое расширение границ сердца влево, приглушенность тонов сердца, негромкий систолический шум в области верхушки)
в) поражение нервной системы – фуникулярный миелоз – возникает при тяжелом и длительном течении болезни, характеризуется поражением задних и боковых столбов спинного мозга с демиелинизацией и дегенерацией нервных волокон в спинном мозге и спинномозговых нервах:
1) при преимущественном поражении задних столбов:
– жалобы на слабость в ногах, особенно при подъеме по лестнице, при быстрой ходьбе, ощущение ползания мурашек по ногам, онемение ног; больным кажется, что они не чувствуют при ходьбе опоры под ногами, что нога наступает не на твердую землю, а на что-то рыхлое, мягкое, как вата (больные неоднократно как бы «пробуют землю ногой»)
– снижение сухожильных рефлексов, атрофия мышц нижних конечностей
– нарушение функции тазовых органов (недержание мочи, недержание кала)
2) при преимущественном поражении боковых столбов:
– нижний спастический парапарез с резким повышением сухожильных рефлексов и тонуса мышц нижних конечностей
– нарушение функции тазовых органов (задержка мочеиспускания и дефекации)
Клиническая картина фолиеводефицитной анемии отличается от В12-дефицитной анемии отсутствием поражения пищеварительной и нервной системы.
Диагностика В12-дефицитной анемии:
1. Лабораторные исследования:
а) ОАК: гиперхромная (ЦП > 1,1) макроцитарная анемия, анизоцитоз (разная величина эритроцитов, наряду с макроцитами имеются эритроциты нормальных размеров), пойкилоцитоз (изменение формы эритроцитов);
тельца Жолли, кольца Кебота, базофильная пунктация (остатки ядра в мегалоцитах); лейкопения, нейтропения, эозинопения, относительный лимфоцитоз, гиперсегментированные нейтрофилы (большие сегментоядерные нейтрофилы с полисегментированным ядром); умеренная тромбоцитопения
б) миелограмма (пункцию необходимо делать до начала лечения!): раздражение красного кроветворного ростка, его гиперплазия; клетки красного ряда преобладают над клетками белого ряда, отношение лейкоциты/эритроциты 1:2 – 1:3 (при норме 3:1-4:1); мегалобластный тип кроветворения (гиганская клетка с эксцентрично расположенным ядром без ядрышек, нежной хроматиновой сетью) с преобладанием в разгар болезни базофильных мегалобластов («синий костный мозг»); изменение клеток миелоидного ряда; нарушение созревания мегакариоцитов
в) БАК: признаки гемолиза (неконьюгированная гипербилирубинемия, умеренное повышение СЖ)
г) тест Шеллинга – позволяет оценить всасывание витамина В12 в кишечнике в присутствии гастромукопротеина или без него и сделать заключение о патогенетическом варианте В12-дефицитной анемии:
1) Шеллинг – I: больному дают принять внутрь витамин В12, меченный 60 Со и через 1-6 часов в/м вводят «ударную дозу» немеченого витамина В12 для насыщения печеночного депо, затем измеряют содержание радиоактивного витамина В12 в суточной моче; снижение его экскреции указывает на нарушение всасывания витамина В12 в кишечнике
2) Шеллинг – II: повторяется тест Шеллинг-I с использованием гастромукопротеина, меченого радиоактивным кобальтом; повышение экскреции радиоактивного витамина В12 указывает на дефицит гастромукопротеина в качестве основного механизма развития В12-дефицитной анемии; если экскреция радиоактивного витамина В12 не увеличилась, причина развития МА – нарушение всасывания витамина
2. Инструментальные исследования: ФГДС с биопсией (атрофические изменения слизистой ЖКТ); исследование желудочной секреции (резкое уменьшение количества желудочного сока, ахилия) и др.
Диагностика фолиеводефицитной МА:
а) ОАК – те же признаки, что и при В12-дефицитной анемии
б) миелограмма – те же признаки, что и при В12-дефицитной анемии; при окраске пунктата по Кассу (ализариновым красным) мегалобласты окрашиваются только при В12-дефицитной анемии и не окрашиваются при фолиеводефитиной анемии
в) БАК: признаки гемолиза (неконьюгированная гипербилирубинемия, умеренное повышение СЖ)
г) проба с гистидином – больной принимает 15 г гистидина, после чего определяется экскреция с мочой формиминглутаминовой кислоты за 8 ч после приема гистидина; в норме основная часть гистидина превращается при участии фолиевой кислоты в глутаминовую кислоту, с мочой выводится от 1 до 18 мг формиминглутаминовой кислоты; при фолиеводефицитной анемии выделение формиминглутаминовой кислоты значительно увеличивается ( до 1500 мг)
При В12-дефицитной анемии – препараты витамина В12 (цианокобаламин, оксикобаламин) 400-500 мкг/сут в/м (30-40 инъекций), затем – поддерживающая доза 500 мкг 1 раз в неделю 3 месяца, затем 500 мкг 1 раз в 2 недели еще 3 мес.
При фуникулярной миелозе 1000 мкг/сут + кобамид (кофермент витамина) 500 мкг/сут в/м до исчезновения признаков поражения спинного мозга.
При фолиеводефицитной анемии: фолиевая кислота внутрь по 10-15 мг/сут до 6 недель.


