Диагностика остеопороза

Для остеопороза характерно снижение минеральной плотности с сопутствующими изменениями количества и микроархитектуры костной ткани, что сопровождается нарушением прочности скелета и повышением опасности переломов, особенно позвоночника, шейки бедра и запястья.
Масса костной ткани зависит от взаимодействия между клетками, формирующими (остеобласты) и разрушающими (остеокласты) кость. Индивидуальный пик костной массы, который в норме достигается к 25-30 годам, зависит от генетических и ненаследст-венных факторов: гормонального статуса, физических нагрузок, питания. Нарушение гор-монального статуса, несбалансированное питание, малоподвижный образ жизни, курение, чрезмерное потребление алкоголя являются факторами риска снижения костной массы Таким образом, остеопороз – гетерогенное заболевание, он может быть классифицирован как первичный или вторичный в соответствии с причинами, ответственными за потерю костной массы.
Диагностика
- низкое содержание кальция в рационе;
- дефицит витамина D;
- заболевания ЖКТ (снижение всасываемости кальция);
- ранняя менопауза;
- длительные периоды иммобилизации
- длительный прием глюкокортикоидов, гормонов щитовидной железы;
- заболевания щитовидной железы, надпочечников, почек, печени;
- низкий индекс массы тела;
- вредные привычки (курение,алкоголь);
- низкая физическая активность.
Денситометрия – измерение плотности костной ткани, основано на измерение минерального компонента костной ткани – кальция.
В настоящее время для ранней диагностики остеопороза используют различные методы костной денситометрии, позволяющие выявить уже 2-5% потери массы кости, оценить динамику плотности костной ткани в процессе развития заболевания или эффективность лечения. Применяются изотопные методы (моно – и двухфотонная абсорбциометрия), рентгеновские (моно – и двухэнергетическая абсорбциометрия, количественная компьютерная томография ) и ультразвуковые. С помощью монофотонной, моноэнергетической и ультразвуковой денситометрии исследуют периферические отделы скелета. Эти методы наиболее подходят для скрининга остеопороза или предварительного диагноза. Наиболее универсальным является применение двухэнергетической рентгеновской абсорбциометрии (DEXA) – золотой стандарт, позволяющей измерять содержание костного минерала в любом участке скелета, а также определять содержание солей кальция, жира и мышечной массы во всем организме. Стандартными (автоматическими) программами для таких денситометров являются программы для поясничных позвонков, проксимальных отделов бедра, костей предплечья и программа “все тело”.
Независимо от того, как рассматривать остеопороз – как заболевание или синдром, – риск переломов, определяемый при денситометрии, не может быть одинаковым для всех костей скелета. Поэтому выбор его участков для исследования является чрезвычайно важ-ным, Чтобы сделать этот выбор, необходимо помнить о том, что в костной ткани имеются два разных слоя. Компактное (кортикальное) вещество вносит основной вклад в прочность кости, но характеризуется невысокой скоростью метаболических процессов. Губчатое (трабекулярное) вещество, напротив, весьма активно в плане обмена веществ. Отмечено, что разные виды остеопороза по-разному сказываются на этих двух слоях.
При преимущественном поражение трабекулярного вещества – развивается постменопаузальный, гипогонадальный, стероидный остеопороз; кортикального вещества – сенильный, гипертиреодный, гиперпаратиреодный, диабетический остеопороз. При многих видах остеопороза наблюдается тенденция постепенного “распространения” остеопороза от осевого скелета (прежде всего позвонков), где появляются первые признаки остеопороза, к периферическому. Поэтому, учитывая чрезвычайную ценность ранней диагностики остеопороза, в целом следует отдать предпочтение исследованию осевого скелета. Исследование периферических отделов (большеберцовая, пяточные кости, фаланги пальцев) часто называют скриниговыми.
Клинические лабораторные исследования
В основе патогенеза развития остеопороза лежит дисбаланс процессов костного ремоделирования (костеообразования) и костной резорбции: либо преобладает ускоренная резорбция, либо сниженое костеообразование, либо замедление обеих составляющих костного обмена. В норме количество новообразованной ткани эквивалентно разрушенной.
Основная цель ранней биохимической диагностики остеопороза состоит в оценке интенсивности костного метаболизма. Для этого используются специальные биохимические маркеры, которые можно разделить на три группы.
Наибольшее значение в дифференциальной диагностике заболеваний скелета метаболического характера имеет оценка гормонального статуса больных, в частности парати-реоидного гормона (ПТГ), половых стероидных и гонадотропных гормонов, а также витамина Д, участвующего с ПТГ в регуляции обмена кальция. Определение концентрации кальция, фосфора и общей активности щелочной фосфатазы сыворотки крови использу-ются в оценке общего статуса больного и имеет вспомогательное, но не диагностическое значение.
Маркеры формирования костной ткани
Остеокальцин – основной неколлагеновый белок костного матрикса, который син-тезируется остеобластами. Синтез остеокальцина зависит от витамина К и Д, что до некоторой степени снижает чувствительность и специфичность определения остеокальцина, как маркера метаболизма костной ткани. Но, именно ,его концентрация в крови отражает метаболическую активность остеобластов костной ткани, поскольку остеокальцин крови – результат нового синтеза, а не освобождения его при резорбции кости. Он синтезируется остеобластами во внеклеточное пространство кости, часть попадает в кровоток, где он и может быть проанализирован. Высокий уровень ПТГ подавляет выработку белка остеобластами, в результате чего снижается его концентрация в костной ткани и в крови. По мнению многих авторов, этот показатель “возможный” прогностический индикатор усиления заболевания костей.
Кальцитонин – полипептидный гормон, выделяемый С-клетками щитовидной железы. Основной эффект кальцитонина – снижение уровня кальция в крови и отложение в кости. По своему действию является антагонистом паратгормона. Кальцитонин действует через специфические рецепторы (в костях, почках), в результате чего тормозится резорбция костей и выход кальция из кости.
Костный фермент щелочной фосфатазы (b ALP) Его исследование, наряду с общей активностью щелочной фосфотазы (ЩФ), существенно повышает информативность при дифференциальной диагностике заболеваний скелета и печени. Щелочная фосфотаза ассоциируется с активностью остеобластов и поэтому ее определение дополняет картину формирования костной ткани.
Маркеры состояния обмена
Паратгормон (ПТГ) – является одним из основных регуляторов кальциево-фосфорного обмена, синтезируется паращитовидными железами в ответ на уменьшение внеклеточной концентрации кальция. Он активирует резорбцию костной ткани и приводит к поступлению кальция и фосфора в кровь. Тиреотроопный гормон (ТТГ), наоборот, способствует усвоению кальция и препятствует его выводу из костной ткани. Между тем, уровень кальция в крови должен быть постоянным, если его мало, то риск развития сердечной патологии высок и регуляторная система нашего организма идет на все, чтобы содержание кальция в крови было нормальным, “забирая” его у скелета, мыщц.
Кальций, фосфор – основные минеральные компоненты костной ткани. Разные формы и стадии остеопороза могут проявляться различными сдвигами в концентрациях этих минералов. Другой аспект проблемы нарушения кальциевого гомеостаза – дефицит витамина Д. Хорошо известно, что с возрастом наблюдается прогрессирующее снижение кишечной абсорбции не только кальция, но и витамина Д, а также образование витамина Д в коже. В 2006 году группа экспертов Американского национального фонда по изучению остеопороза показала, что лечение препаратами кальция и витамина Д экономически эффективно и выгодно в целях профилактики остеопороза.
Остеокальцин норма у женщин в менопаузе
- Москва, ул. 2-я Песчаная, 8
- +7 (495) 150-37-67, +7 (499) 157-37-67
Современная лабораторная диагностика остеопороза.

Значимость заболевания в современном обществе и медицине определяется его распространённостью среди населения, тяжестью течения и исходов, экономическими потерями больного, семьи и общества в целом. Остеопороз (ОП) – системное метаболическое заболевание скелета, характеризующееся снижением массы костной ткани и нарушением микроархитектоники её строения, что снижает прочность кости и увеличивает риск переломов. По мнению экспертов ВОЗ, ОП сегодня – одно из наиболее распространённых заболеваний, которое наряду с инфарктом миокарда, инсультом, раком и внезапной смертью занимает ведущее место в структуре заболеваемости и смертности населения.
Результаты многочисленных исследований убедительно доказали, что костная масса является главной детерминантой механических свойств костной ткани и определяет 75-80% её крепости. Риск переломов прямо связан с абсолютными значениями минеральной плотности костной ткани (МПКТ) позвоночника и шейки бедра, а костная денситометрия – единственный достоверный метод, позволяющий установить степень снижения костной массы. Риск перелома увеличивается с возрастом, который главным образом связан у пожилых людей с низкой МПКТ. Риск перелома бедра возрастает в 2-3 раза при каждом снижении МПКТ шейки бедра на одно стандартное отклонение в соответствии с критериями ВОЗ.
Патогенез остеопороза.

ОП сегодня широко используется как модель фундаментальных исследований в изучении молекулярных механизмов межклеточного взаимодействия. ОП – многофакторное заболевание, в основе которого лежат процессы нарушения костного ремоделирования с повышением резорбции костной ткани и снижением костеобразования. Ремоделирование костной ткани начинается с резорбции, осуществляемой в процессе остеокластогенеза с образованием полости резорбции. Остеобласты (ОБ) “атакуют” полость резорбции, где строят новый костный матрикс для последующей минерализации. Оба процесса костеобразования тесно связаны. Образование кости превышает резорбцию в течение роста скелета, и наоборот, резорбция превалирует в течение последующего периода жизни человека. Оба процесса костеобразования являются результатом тесного клеточного взаимодействия ОБ иостеокластов (ОК), которые берут начало от предшественников различных клеточных линий, а именно: ОБ – из мезенхиальных стволовых клеток, ОК – из макрофагально-моноцитарных клеток крови.
Кость формируется остеобластами. Основная их функция – синтез остеоида (протеинового матрикса), который на 90-95% состоит из коллагена 1 типа, на 5% из белка остеокальцина и впоследствии минерализуется кальцием и фосфатом из внеклеточной жидкости. ОБ содержат фермент щёлочную фосфатазу, несут рецепторы к паратиреоидному гормону (ПТГ) и кальцитриолу и способны к пролиферации. Минеральная часть кости состоит из гидроксиапатита и аморфного фосфата кальция, которые нековалентно связаны с белками органического матрикса
Резорбция кости осуществляется остеокластами. Это подвижные клетки. Выделяя протеолитические ферменты и кислую фосфатазу, вызывают деградацию коллагена, разрушение гидроксиапатита и выведение минералов из матрикса. Имеется корреляция между активностью тартратрезистентной кислой фосфатазы в сыворотке крови и выраженностью резорбтивных процессов в кости.
В норме оба процесса – образование и разрушение уравновешены.
Сроки физиологического ремоделирования кости.
| Фаза резорбции кости | 14-30 дней |
| Switch-over фаза (простагландин Е2 ответственен за апоптоз остекластов) | 10 дней |
| Фаза формирования кости | 90 дней |
| Фаза отдыха | 900 дней |
Биологический смысл феномена ремоделирования кости состоит в приспособлении механических свойств кости к постоянно меняющимся условиям окружающей среды. Рост и обновление скелета сопровождается регенерацией микроповреждений и поддержанием возможности перехода минералов в кровь и обратно. У взрослых людей остеобласты продуцируют чуть меньше костной ткани, чем требуется. Следствием этого является отрицательный баланс кости, который составляет 0,5-1% ежегодно. Данный феномен известен как «ассоциированная с возрастом остеопения».
Значительный прогресс в понимании остеокластогенеза был достигнут с открытием недавно новых членов семейства факторов некроза опухоли, их лигандов и рецепторов (RANKL-RANK-ОРG), которые играют ключевую роль в формировании, дифференцировке и активности ОК и могут быть молекулярными посредниками многих регуляторов. Молекулярная основа межклеточного взаимодействия может быть представлена следующим образом. RANKL (receptor activation of NF-kappa -ligand) – трансмембранный лиганд, экспрессированный на поверхности ОБ. Он продуцируется остеобластами и индуцирует процесс дифференцировки и созревания ОК. RANKL является основным стимулирующим фактором в образовании зрелых остеокластов. Поэтому увеличение экспрессии RANKL приводит к резорбции костной ткани и, следовательно, к потере костной массы.
OPG-остеопротегерин – остеокластингибирующий фактор, гликопротеин, широко экспрессированный в различных тканях, является мощным ингибитором костной резорбции. OPG действует для RANKL как “мнимый” рецептор, блокирует взаимодействие с RANK и таким образом ингибирует формирование зрелых ОК, нарушает процесс остеокластогенеза и резорбцию костной ткани. Баланс между RANKL и OPG фактически определяет количество резорбированной кости.
Недавно были получены данные, что Т-клетки принимают участие в регуляции костного метаболизма. При индукции интерлейкина-17 (IL-17),который в эксперименте индуцировал экспрессию СОХ-2-зависимого простагландина Е2 и RANKL в ОБ, авторы пришли к заключению, что IL-17 – важный цитокин для остеокластной резорбции. Однако наиболее важными медиаторами для действия различных систем в процессе ремоделирования костной ткани как в норме, так и при ОП является в настоящее время система RANKL-RANK-OPG.
Факторы, играющие важную роль в патогенезе ОП и его переломов: генетические, формирование низкого пика костной массы, потеря минеральной плотности кости, ассоциированная с возрастом и постменопаузой, нарушение архитектоники строения кости, особенности геометрии кости (бедра), травмы и падения, питание с низким содержанием кальция и витамина D, белка и др., низкая двигательная активность, вредные привычки (курение, алкоголь). При вторичном ОП к перечисленным факторам присоединяются факторы заболевания, отрицательного действия лекарственных препаратов (глюкокортикостероиды, иммунодепрессанты и др.), которые вызывают потерю костной массы и ОП.
Снижение костной массы при ОП, которое является основным фактором его патогенеза, рассматривается сегодня как следствие формирования неадекватно низкого пика костной массы в молодом возрасте и интенсивной потери кости, связанной с возрастом, в пожилом возрасте. Генетические факторы – главные детерминанты пика костной массы. Вклад генетических факторов составляет 60-80% в зависимости от методов исследования (близнецы, семьи). Различные гены рассматриваются в качестве кандидатов, участвующих в сложном процессе ремоделирования, формирования и эволюции костной массы, приводящих к ОП и переломам. Многочисленные комплексные исследования различных лабораторий мира направлены на поиск конкретных генов, изучение их полиморфизма, функции и взаимодействия в процессе костного ремоделирования и ОП.
Первичный остеопороз
Остеопороз, развивающийся в периоде постменопаузы, относится к классу первичных остеопорозов. Известно, что снижение секреции половых гормонов в период климактерия оказывает прямое и опосредованное влияние на состояние костного метаболизма. Снижение содержания эстрогенов приводит к нарушению кальциевого обмена, что сопровождается уменьшением минеральной плотности костной ткани. Кроме того, имеет место подавление активности остеобластов, что приводит к преобладанию резорбции над процессами формирования костной ткани. Постменопаузальный остеопороз составляет 85% общего количества первичного остеопороза.
Сенильный остеопороз – так называемый второй тип остеопороза, в патогенезе которого важную роль играет снижение всасываемости кальция в кишечнике, чему также способствует дефицит витамина D, вызванный уменьшением поступления его с пищей, замедлением образования его в коже из провитамина D. Наибольшее значение в патогенезе сенильного остеопороза имеет дефицит активных метаболитов витамина D вследствие снижения его синтеза в почках. При сенильном остеопорозе определённую роль играет развитие резистентности к витамину D – т.е. дефицит рецепторов 1,25(ОН)2D. Указанные факторы вызывают развитие транзиторной гипокальциемии, что приводит к усилению продукции паратиреоидного гормона. В результате вторичного гиперпаратиреоза усиливается резорбция костной ткани, в то время как костеообразование к старости снижено.
Вторичный ОП
Серьёзной медицинской проблемой является и вторичный ОП, возникающий при различных заболеваниях: ревматологических, эндокринологических, онкологических, обструктивных заболеваниях лёгких и бронхиальной астмы, заболеваниях почек, щитовидной железы, органов пищеварения, при иммобилизации и длительном приёме ряда медикаментов (кортикостероиды, иммунодепрессанты, антиконвульсанты, тиреоидные гормоны и др.).
Снижение МПКТ при вторичном ОП часто достигает критериальных величин ОП (-2,5 SD и более по Т-критерию) и даёт основание поставить диагноз.
У больных ревматоидным артритом (РА) в постменопаузе развитие ОП имело место в поясничном отделе позвоночника и шейке бедра у 36%, в предплечье у 40%, а у пациентов с сохранённым менструальным циклом – у 7 и 10% соответственно. Возраст больных и длительность менопаузы, наличие факторов риска, активность и длительность заболевания, степень функциональной недостаточности суставов, проводимая терапия (особенно назначение глюкокортикоидов – ГК) оказывают влияние на величину потери МПКТ и развитие остеопении. При обследовании больных с эндогенным гиперкортицизмом (синдром и болезнь Иценко-Кушинга) ОП обнаружен у 91%, переломы тел позвонков или рёбер – у 58%. ОП у больных бронхиальной астмой значительно утяжеляет течение основного заболевания, увеличивает стоимость лечения. По данным доктора И.А.Барановой, снижение МПКТ было выявлено у 42,8% больных бронхиальной астмой 20-49 лет, ранее не получавших гормональную терапию, и потеря МПКТ увеличивалась в 5 раз при среднетяжёлом течении (53,5%) по сравнению с легким (11%). У больных молодого и среднего возраста, принимавших ГК в средней дозе 10,20±5,99 мг/сут на протяжении 8-14 лет, снижение МПКТ обнаружено у 85%, у 13% зарегистрированы переломы скелета. В качестве причины развития ОП при РА, ряде воспалительных заболеваний, бронхиальной астме обсуждается непосредственное влияние самого заболевания на костную ткань, поскольку известно большое число общих цитокинов, принимающих участие в патогенезе хронического воспалительного процесса и костного ремоделирования, а также ГК, которые наиболее эффективны для базисной терапии при ряде системных заболеваний и в то же время занимающих ведущее место в индукции вторичного ОП. Изучение переломов при вторичном ОП остаётся актуальной задачей.
Стероидный остеопороз также относится к классу вторичных остеопорозов и вызывается патологическим повышением эндогенной продукции глюкокортикоидов надпочечниками или возникает при введении синтетических аналогов кортикостероидов, применяемых для лечения ревматологических, аллергических, гематологических, глазных болезней, заболеваний кожи, желудочно-кишечного тракта (ЖКТ), почек, печени. Стероидный остеопороз возникает при заболеваниях, характеризующихся повышенной секрецией кортикостероидов надпочечниками (Иценко-Кушинга).
Биохимические маркеры костного метаболизма
Их исследуют для оценки скорости протекания процессов костного ремоделирования и диагностики остеопороза с высоким или низким темпом костного обмена, разобщённости или дисбаланса его составляющих: костной резорбции и костеобразования. Разделение показателей на маркеры образования и резорбции кости является условным. Совместно они отражают итоговые изменения резорбции и костеобразования, направленные в ту или иную сторону.
Наиболее точными маркерами костного образования в настоящее время признают исследование содержания остеокальцина, коллагена 1 типа, остеопротегерина (OPG), Интерлейкина 17 в крови.
К маркерам резорбции костной ткани относят экскрецию оксипролина с мочой, определение пиридинолина, деоксипиридинолина и N-концевого телопептида в моче натощак, активность кислой тартратрезистентной фосфатазы, а также определение продуктов деградации коллагена 1 типа (Cross–Laps) и RANKL (receptor activation of NF-kappa -ligand) в крови.
Исследование маркеров костного ремоделирования целесообразно для:
1. Динамической оценки костного метаболизма;
2. Прогноза потери костной массы (вторичная профилактика при выявленной остеопении);
3. Прогноза перелома костей;
4. Отбора пациентов для проведения терапии;
5. Быстрого мониторинга терапии.

Процесс костного ремоделирования регулируется многими системными гормонами, цитокинами, факторами роста, идентифицированы многие локальные факторы костного ремоделирования. При изучении ОП важна оценка параметров минерального кальций-фосфор-магниевого обмена (уровень общего и ионизированного кальция, фосфора, магния, меди, цинка, витаминов С и К), которые вовлечены в процесс костеобразования.
Гормональная регуляция уровня кальция в кости.
– паратиреоидный гормон – стимулирует резорбцию кости опосредованно воздействуя на остеокласты;
– кальцитонин – снижает количество остеокластов и тормозит их активность;
– эстрогены – подавляют активность остеокластов;
– андрогены – стимулируют пролиферацию остеоцитов и усиливают процессы костного синтеза;
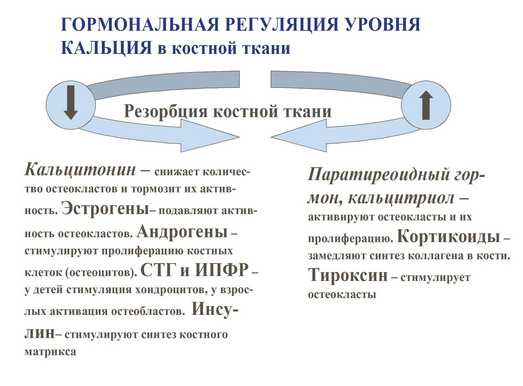
– гормон роста и инсулинподобный фактор роста 1 (соматомедин-С) – активируют процесс синтеза кости за счёт стимуляции остеобластов;
– инсулин – стимулирует синтез костного матрикса;
– тироксин – стимулирует остеокласты, усиливая резорбцию костной ткани;
– кортикостероиды – замедляют синтез коллагена в костной ткани;
Из вышеперечисленного следует, что изучение уровня этих гормонов и маркеров костного ремоделирования на ранней стадии развития остеопении, особенно при вторичном ОП, позволит спрогнозировать и оценить вероятность дальнейшей резорбции костной ткани, провести профилактику ОП, назначить лечение.
Остеопороз и остеопения у женщин в менопаузе

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 24.04.2020
- Время чтения: 1 mins read
Остеопороз – это системное заболевание, когда процессы распада костной ткани преобладают над процессами восстановления и образования новых костных клеток. Остеопения – это описание состояния костной ткани.
Что такое остеопороз и остеопения. Чем опасен остеопороз
Как и другие органы, кости – это живые ткани, проходящие собственный «круг жизни». За формирование, поддержание и реабсорбцию костной ткани отвечают различные типы костных клеток. В молодом или растущем организме костные клетки создают костную ткань быстрее, чем ткани умирают и реабсорбируются. С возрастом расстановка сил меняется.
У людей с остеопорозом, кости становятся ломкими и хрупкими, поэтому подвержены риску перелома. Патология может быть настолько серьезной, что риск переломов увеличивают незначительные травмы и даже кашель.
Остеопения это не диагноз, а описание состояния костной ткани. Дословно «остеопения» означает «низкая костная масса». Остеопения, если она вообще случается, обычно возникает в возрасте около 50 лет. Точный возраст зависит от того, насколько крепка костная ткань в молодости.
При крепкой и здоровой костной системе остеопения не развивается, и наоборот, при ослабленной она может развиться в более молодом возрасте ещё до наступления менопаузы.
Остеопения обычно не имеет никаких явных симптомов. Это затрудняет диагностику. Если не проведен тест на минеральную плотность костной ткани и патология не лечится, остеопения приведет к остеопорозу.
С возрастом прочность костей уменьшается, следовательно, возрастает риск развития остеопороза. Более подвержены этой болезни женщины, особенно белой и монголоидной расы. Поэтому всем женщинам до наступления менопаузы и после нее рекомендуется принимать профилактические меры против остеопороза, пока кости еще относительно здоровы.
Симптомы остеопороза
Одна из опасностей остеопороза заключается в том, что внешних симптомов, предупреждающих о начале развития этой патологии, нет.

Остеопороз – состояние костей
Через много лет, когда кости уже ослабли, женщина может заметить такие признаки, как боль в спине, уменьшение роста или сутулость. Для большинства пенсионеров первым признаком наличия остеопороза становится перелом, обычно бедренной кости или позвоночника.
Поздние симптомы остеопороза:
- Боль в спине.
- Сгорбленность или сутулость.
- Уменьшение роста с течением времени.
- Неожиданные переломы костей.
При появлении первых симптомов остеопороза, важно как можно раньше обратиться к врачу, чтобы предотвратить дальнейшую потерю костной массы.
Факторы риска развития остеопороза
Есть некоторые факторы риска развития остеопороза. К ним относятся:
- Пол. По некоторым оценкам, приблизительно у одной трети женщин старше 50 лет (часто в постменопаузе) наблюдается остеопоротический перелом. Что касается мужчин: переломы, связанные с остеопорозом регистрируются у каждого пятого.
- Возраст. Когда вы становитесь старше, риск развития остеопороза увеличивается.
- Генетика. Остеопороз считается наследственным заболеванием. Если история семьи показывает, что у близких родственников был диагностирован остеопороз или в анамнезе был перелом бедра, это подвергает вас большему риску развития заболевания.
- Масса тела и рост. Когда скорость обновления костей начинает замедляться более высокому риску развития остеопороза подвергаются невысокие и миниатюрные люди. Это связано с тем, что у них меньше костной массы.
- Расовая принадлежность. Азиатские и белые женщины, как правило, болеют остеопорозом чаще, чем чернокожие и латиноамериканки. Точно не известно, почему так происходит, но, скорее всего, это связано с сочетанием нескольких факторов, включая наследственность, различия в размерах тела, гормональный статус, плотность костной ткани и культурные обычаи, которые могут повлиять на диету и физическую активность.
- Гормоны. Поскольку эстроген оказывает защитное действие на костную ткань, уменьшение эстрогена во время менопаузы может ее ослабить. Это одна из причин, почему женщины страдают от остеопороза чаще, чем мужчины.
Установлены также модифицируемые факторы риска, которые могут способствовать возникновению остеопороза. К ним относятся:
- Лекарственные препараты. Некоторые стероиды увеличивают риск развития остеопороза при длительном приеме. Кортикостероиды, такие как преднизолон, кортизон и гидрокортизон, ослабляют костную ткань, тормозя процесс обновления костей. Также известно, что увеличивают риск развития остеопороза некоторые лекарства, используемые для лечения рака, судорог, рефлюксной болезни желудка и предупреждения отторжения трансплантата.
- Анорексия. Анорексия, еще одно заболевание, чаще встречающееся у женщин, чем у мужчин. В этом случае преднамеренный отказ от еды или потеря аппетита вследствие заболеваний лишает организм питательных веществ и приводит к потере плотности и хрупкости костной ткани.
- Физическая активность. Поднятие тяжестей заставляет тело строить крепкие кости. Люди, которые ведут сидячий образ жизни, как правило, подвергаются большему риску остеопороза.
- Алкоголь и табак. Обе эти вредные привычки повышают риск развития остеопороза.
Патологические состояния, увеличивающие риски развития остеопороза
Риск остеопороза выше у людей, имеющих определенные проблемы со здоровьем, к которым относятся:
- Целиакия (абсолютная непереносимость глютена).
- Воспалительное заболевание кишечника (болезнь Крона или язвенный колит).
- Болезни почек или печени.
- Злокачественное новообразование.
- Системная красная волчанка.
- Множественные миеломы.
- Ревматоидный артрит.
Предотвращение потери костной массы и переломов
Профилактика остеопороза и остеопении может быть абсолютно невозможна для некоторых людей, независимо от их желания. Есть множество неконтролируемых факторов риска, которые увеличивают риски развития этих состояний.
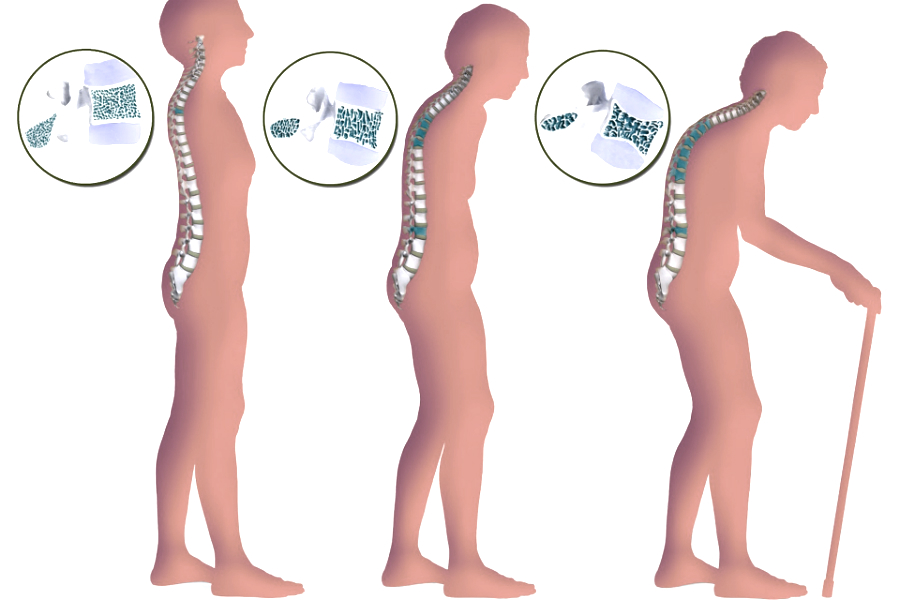
Последствия остеопороза
Снижение риска развития патологии начинается со здорового образа жизни еще в юном возрасте. Если в молодости вы накопили достаточно костной массы, вы можете избежать остеопороза с возрастом. Помочь своим костям оставаться крепкими и избежать переломов в результате остеопороза, можно придерживаясь некоторых правил:
- Избегайте курения.
- Избегайте употребление алкоголя. Прием более двух алкогольных напитков в день нарушает процесс обновления костной и соединительной ткани.
- Получайте достаточное количество добавок кальция и витамина D. Это может быть самым важным, что вы можете сделать для своих костей на любой стадии жизни.
- Соблюдайте осторожность. Это правило применимо ко всем, но требует особого внимания со стороны людей преклонного возраста. Предотвращение падений помогает снизить риск переломов, вызванных остеопорозом.
Проведите проверку безопасности вашего дома на наличие мешающих электрических шнуров, скользящих ковриков и скользких полов. Установите поручни и нескользящие подушки в душе и ванной. Носите удобную обувь с нескользящей подошвой в любое время года, в том числе дома.
Диагностика
Методы постановки диагноза остеопороз включают:
- Сбор анамнеза. Опрос о наличии хронических или других диагностированных заболеваний, времени начала менархе;
- Осмотр. Физический, антропометрия, сравнение полученных антропометрических показателей с данными измерений в молодом возрасте;
- Центральный лучевой метод оценки плотности костной ткани (DEXA);
- Ультразвуковые и периферические лучевые методы диагностики;
- Лабораторные исследования.
- Сканирование плотности кости, также известное как двухэнергетическая рентгеновская абсорбциометрия (DEXA) – быстрый, безболезненный и неинвазивный тест состояния костной ткани.
- Во время процедуры запястье, бедро и позвоночник сканируются с помощью низкоуровневого рентгеновского аппарата. Часто такое обследование не рекомендуется женщинам младше 65 лет.
Периферические тесты
- Более безопасны и доступны скрининговые тесты, также называемые периферическими тестами, которые измеряют плотность кости в нижней части руки – запястье, пальце или пятке. Типы периферических тестов:
- pDXA (периферическая двухэнергетическая рентгеновская абсорбциометрия);
- QUS (количественное ультразвуковое исследование пяточной кости);
- pQCT (периферическая количественная компьютерная томография).
Лабораторные методы исследования на остеопороз
Для диагностики остеопороза необходимы дополнительные исследования, особенно у женщин в пременопаузе и перименопаузе, поскольку распространенность вторичных причин остеопороза в этих группах высока. Эти лабораторные исследования позволяют точно установить вторичные причины остеопороза и оценить состояние организма, подтвердить/исключить сопутствующие заболевания и определить дальнейшую тактику лечения остеопороза.
Для относительно здоровых женщин в постменопаузе, у которых по результатам анамнеза и физического осмотра нет данных, указывающих на заболевание остеопорозом, связанное с патологией, некоторые лабораторные исследования можно исключить. Но основная масса тестов обязательна. Должны проводиться анализы на тиреотропин, полный анализ крови, анализ мочи, биохимическая оценка состояния печени.
| Лабораторный тест | Обоснование/дифференциальный диагноз |
| Сывороточный креатинин | Почечная недостаточность, связанная с вторичным гиперпаратиреозом. |
| Функциональные тесты печени | Внутренние заболевания печени и холестатические расстройства, связанные с многофакторными причинами повышенного риска развития остеопороза. |
| Сывороточный кальций | Увеличение: наблюдается при гиперпаратиреозе. Снижение: при мальабсорбции или дефиците витамина D. |
| Щелочная фосфатаза | Увеличение связано с болезнью кости Педжета, длительной иммобилизацией, острыми переломами и другими заболеваниями костей. |
| Сывороточный фосфор | Уменьшение связано с остеомаляцией. |
| Исследования щитовидной железы (тиреотропин и тироксин) | Гипертиреоз-связанная потеря плотности кости. |
| Скорость седиментации или С-реактивный белок | Может указывать на воспалительный процесс или моноклональную гаммопатию, связанную с потерей костной массы. |
| Полный анализ крови | Оценка злокачественности костного мозга, инфильтративных процессов (анемия, низкий уровень лейкоцитов или низкий уровень тромбоцитов) или мальабсорбции (анемия, микроцитоз или макроцитоз). |
| Выделение кальция с мочой | 24-часовая экскреция кальция с мочой на диете с высоким потреблением кальция проверяет мальабсорбцию и гиперкальциурию – исправимую причину потери костной массы; |
Лечение остеопении и остеопороза
Исходя из результатов обследования состояния костной ткани, наличия/отсутствия заболеваний и вторичных факторов риска, женщине рекомендуется индивидуальный план лечения.
Иногда требуются лишь незначительные изменения в образе жизни, в обязательном порядке рекомендуется диета с употреблением продуктов, содержащих кальций в растворимой форме (молочные и кисломолочные продукты) и микроэлементы (магний, калий, фосфор).
Рекомендуется отказ от вредных привычек (алкоголь и курение выводят кальций).
Группы лекарственных средств для лечения остеопороза:
- Бисфосфонаты;
- Кальцитонин;
- Заместительная гормональная терапия;
- RANK ингибитор лиганда;
- Селективные модуляторы рецепторов эстрогена (SERMs);
- Аналоги паратиреоидного гормона.
Комбинация кальция и витамина D . В качестве базовой терапии, улучшающей метаболизм костной ткани относится назначение препаратов кальция (1000-1200 мг) в сочетании с витамином D (800 МЕ) в суточной дозировке.
Бифосфонаты. К наиболее распространенному фармакологическому методу лечения остеопороза относится применение бисфосфонатов. В эту группу препаратов входят Фосамакс, Акласта и Бонива. Бисфосфонаты можно принимать внутрь (еженедельно или ежемесячно) или внутривенно (ежеквартально или ежегодно).
ЗГТ. Если применение бисфосфонатов невозможно из-за наличия противопоказаний, то еще одним вариантом, который поможет увеличить плотность костной ткани, может быть заместительная гормональная терапия. Эстрогенотерапия не относится к методу лечения остеопороза как такового, но эффективна и рекомендуется женщинам с выраженными симптомами менопаузы и предрасположенностью к заболеваниям костно-мышечной и соединительной ткани, в том числе, остеопорозу.
К сожалению, эстрогенная терапия несет в себе некоторые риски, поэтому дозировка и препараты подбираются индивидуально.
Контроль эффективности фармакологического лечения остеопороза включает ежегодное исследование состояния костной ткани при помощи лабораторных методов и/или центрального сканирования (DEXA) и периферического тестирования.
Гиперпаратиреоз. Заболевание (пара)щитовидных желез.

Эта тема стала вызывать живой интерес среди врачей разных специальностей. Прежде всего потому, что гиперпаратиреоз может быть в основе таких распространённых патологий, как мочекаменная болезнь, желчнокаменная болезнь, гипертоническая болезнь, язвенная болезнь желудка. Особенно, если эти 4 патологии присутствуют одновременно. Есть еще 5 патология, часто сопровождающая этот квартет – остеопороз, но он может быть не виден, пока не будет поведено исследование костей методом рентгена или рентгеновской денситометрии.
Гиперпаратиреоз (ГПТ) – синдром, обусловленный повышенной/патологической продукцией паратгормона – основного гормона, регулирующего кальций-фосфорный обмен в организме и обмен витамина Д.
ГПТ занимает 3 место по распространённости среди эндокринных заболеваний после сахарного диабета 1 и 2 типа, диффузно-токсического зоба. Чаще встречается у женщин. Сейчас ГПТ стал лучше диагностироваться (во-первых, про него знают, во-вторых, усовершенствовались методики его диагностики).
Ещё раз повторюсь, основные появления ГПТ:
- ЖКБ
- МКБ (особенно коралловидные камни почек)
- язвенная болезнь желудка и 12-перстной кишки
- остеопороз
- гипертоническая болезнь
или сочетание трех из данных патологий, особенно с началом в молодом возрасте, может являться поводом для диагностики ГПТ.
Коралловидные камни почек – самостоятельная причина для диагностики ГТП.
По статистике 27% пациентов с АГ имеют бессимптомное течение гиперпаратиреоза.
Кроме того, рак молочной железы и простаты, могут провоцироваться гиперпаратиреозом.
Другие проявления гиперпаратиреоза встречаются в различной степени выраженности у разных пациентов:
- быстрая мышечная утомляемость, особенно при физической нагрузке (а не судороги)
- боли в мышцах (вплоть до паралича мышц тазового пояса), костях, «утиная походка»
- частое безболезненное мочеиспускание
- жажда
- снижение памяти
- депрессивные расстройства, психозы
- подташнивание (рвота реже встречается)
- зуд кожи
- панкреатит
- камни уретры и т.д.
Различают формы гиперпаратиреоза по клиническому течению (в зависимости от уровня поражения) – костная (3 подтипа – по типу остеопороза, фибозно-кистозная, педжетоидная форма), висцеральная (органная), смешанная.
NB!Сейчас участились случаи сочетания гиперпаратиреоза и диффузно-узлового зоба, поэтому все! больные с узловыми образованиями должны быть обследованы на уровень паратгормона в крови, кальций общий, ионизированный, фосфор.
По причине повышения паратгормона крови выявляют гиперпаратиреоз первичный – самостоятельное заболевание! 1 случай на 2000 человек (причины – аденома/аденомы (доброкачественные опухоли) паращитовидных желез, аденокарциномы (злокачественные) опухоли паращитовидных желез – всего 2% случаев). Паратиром обычно несколько, так как и паращитовидных желез, минимально 4 в организме.
К первичному гиперпартиреозу относят такие генетические синдромы как МЭН 1 и МЭН 2А (множественные эндокринные неоплазии). Это сочетание гиперпаратиреоза с опухолями других эндокринных органов – рак щитовидной железы (медуллярный) , опухоль поджелудочной железы, опухоль надпочечников- феохромоцитома и т.д.).
Синдром других заболеваний – вторичный гиперпаратиреоз,
Повышение ПТГ физиологическое на фоне гипокальциемии разных причин: хроническая почечная недостаточность, и самая частая причина повышения паратгормона – дефицит витамина Д (витамина солнца), его длительная хроническая нехватка, особенно в дозах ниже 14 нгмл, называется «рахитом у взрослых», а правильнее -остеомаляция, и может привести к образованию обратимой гиперплазии паращитовидных желез с повышенной продукцией паратгормона.
Третичный гиперпаратиреоз (чаще вследствие почечной недостаточности уже на гемодиализе!). Это формирование аденомы паращитовидных желез при длительно существующем вторичном гиперпаратиреозе.
Из лабораторных анализов обращает на себя внимание различие в концентрации кальция/фосфора при разных формах ГПТ.
Например, при первичном гиперпаратиреозе – паратгормон в крови повышен, кальций повышен!! (но может быть и нормальная концентрация в крови – нормокальциемический вариант гиперпаратиреоза) 25-ОН витамин Д повышен, фосфор крови снижен, кальций суточной мочи повышеннормальный (особенно нормокальциурия – подтверждает первичный гиперпаратиреоз) . Кроме того повышено соотношение (более 32) хлор/фосфор – как проявление первичного гиперпаратироеза и его действия на почки.
Вторичный гиперпаратиреоз – паратгормон в крови повышен, кальций снижен. фосфор крови повышен, кальций суточной мочи повышен, 25-ОН витамин Д снижен.
При гиперпаратиреозе может наблюдаться дислипидемия, то есть атеросклероз! (повышение ЛПОНП-липопротеидов очень низкой плотности – «плохих жиров», повышен коэффициент атерогенности), что устраняется после оперативного вмешательства.
Итак, диагностика ГПТ включает:
- кровь на кальций ионизированный, общий, фосфор, паратгормон, щелочную фосфатазу, остеокальцин, креатинин, сахар крови, ТТГ, Т4 свободный
- суточная моча на потерю кальция и фосфора
- УЗИ щитовидной железы и паращитовидных желез (есть такая зависимость – при МКБ +гиперпаратиреозе – аденома паращитовидной железы чаще локализуется слева и др.)
- ЭКГ (могут быть изменения – такие как брадикардия, двугорбый ST, укорочение QT и др.)
- лучший метод визуализации паращитовидных железы!сцинтиграфия методом субтракции), проводят в ГБ №31.
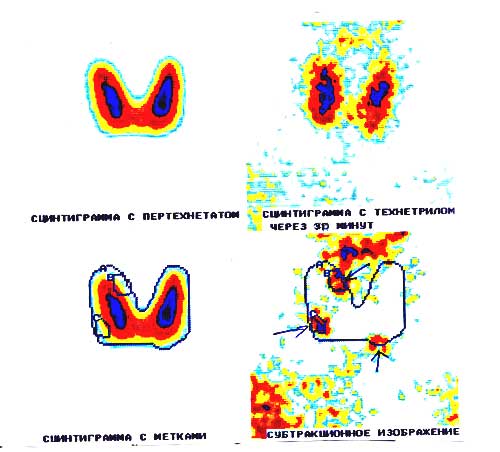
- рентген костей – наблюдаются явления субпериостальной резорбции, а также для гиперпаратиреоза характерна картина «мыльной пены» за счёт множественных мелких кист, бедренная кость в виде «пастушьего посоха», «колоколообразная» грудная клетка, «рыбьи» позвонки, кальцификация хрящей, истончение кортикального слоя зубных альвеол)
- липидограмма,
- УЗИ ОБП и почек,
- общий белок + белквые фракции+ М – градиент, белок Бенс-Джонса в моче,
- в клиническом анализе крови наблюдается – анемия (угнетение эритропоэза), лейкопения, эозинопения, лимфоцитоз, повышение СОЭ,
- при осмотре окулиста – отложение солей в глазном яблоке «рисовые зёрна» – при выраженном случае видно без щелевой лампы.
- денситомерия – подтверждение остеопороза.
- увеличивается концентрация лимонной кислоты на 70-80%.
Медикаментозные тесты диагностики.
N.B.!Тест с тиазидными диуретиками – до теста определяют потерю кальция с мочой, кальций и паратгормон крови, затем дают Гипотиазид 50 мг * 2 раза/сут, 3 дня, и см. те же параметры, если – вырастет уровень кальция крови, паратгормон останется неизменным, уменьшится экскреция кальция с мочой, то это Первичный ГПТ.
Тест с гидрокортизоном – по100-200 мг/сут 10 дней ,при гиперпаратиреозе концентрация кальция крови не меняется , при других причинах снижается. (саркоидозе, болезнях крови и др .).
Кроме того, проводится пробное лечение витамином Д: при первичном гиперпаратиреозе, уровень кальция резко повысится, при вторичном гиперпаратиреозе – уровень кальция не меняется.
Лечение: первичного и третичного гиперпаратироеза – только оперативное! Иначе человеку грозит гиперапартиреиодный криз, а это жизнеугрожаемое состояние! особенно при уровне общего кальция более 3 ммоль/л и более 400 мг/выделения кальция в суточной моче).
Показания к оперативному вмешательству:
- эпизоды гиперкальциемических кризов, (даже один. )
- уменьшение клиренса креатинина на 30% от возрастной нормы,
- увеличение экскреции кальция с мочой более чем в 2-3 раза, (10 ммоль/сут или 400 мг/24 часа),
- МКБ,
- тяжёлый остеопороз, (Т критерий более !- 2.5 ),
- существенное увеличение серологической концентрации кальция крови. (кальций ионизированный более 3.0 ммоль/л).
Противопоказания к операции – ХПН (хроническая почечная недостаточность).
При более мягких формах и противопоказаниям к операции можно провести лечение ГЗТ (особенно у женщин в менопаузе), ГЗТ снижает немного уровень сыворотчного кальция и лечение бисфосфанатами.
Есть дополнительная альтернатива – это лечение кальций- миметиками (это антагонист кальцийчувствительных рецепторов –снижает концентрацию паратгормона и кальция крови) –МИМПАРА 30 мг, 60 мг, 90 мг, используется совместно с бисфосфонатами.
Мимпара используется только при вторичном и третичной ГПТ!
Данных для использования при первичном гиперпаратиреозе нет.
При первичном гиперпаратиреозе (до операции), под контролем уровня кальция крови;
дополнительная жидкость( 2-2.5-3 л/сут)+лечение бисфосфонатами.
Гиперпаратироез, если он вызван нехваткой витамина Д и кальция, может быть пролечен медикаментозно, и понятно какими препаратами – витамина Д и кальция. Витамин Д используется в больших дозах – 40000 единиц еженедельно первые 8 недель, потом по 20000 в неделю под контролем биохимии крови.
Остеопороз у женщин
Остеопороз – заболевание, при котором кости становятся слабыми и хрупкими. В результате переломы могут происходить даже при минимальной травме. Наиболее часто возникают переломы шейки бедра, позвонков и лучевой кости, однако встречаются переломы и в других отделах скелета.
Согласно данным Всемирной организации здравоохранения, остеопороз является четвертой по значимости причиной инвалидизации и смертности пожилых людей в развитых странах. В 2010 году расчетное число людей с высоким риском переломов составляло 158 миллионов и предполагается, что к 2040 году эта цифра увеличится вдвое.

Если переломов нет, кому необходимо обследоваться на предмет остеопороза?
Скрининг для выявления высокого риска переломов рекомендован среди всех женщин в постменопаузе. На первом этапе обследование проводится с помощью алгоритма FRAX– он позволяет определить индивидуальную 10-летнюю вероятность перелома бедра и основных низкотравматических переломов.
Следует оговориться, что при наличии характерных для остеопороза переломов (низкотравматические переломы лучевой кости, бедра, плеча и компрессионные переломы позвонков), диагноз остеопороза устанавливается независимо от FRAX и значения денситометрии.
Как проводится диагностика остеопороза?
Основным методом оценки плотности костной ткани является рентгеновская денситометрия. Она проводится при сомнительном показателе риска переломов для уточнения тактики лечения, а также как инструмент оценки эффективности лечения остеопороза. Кроме того, рентгеновская денситометрия используется для оценки динамики состояния костной плотности у лиц без терапии. Исследование проводится с интервалом в 12 месяцев.
Исследование проводится в двух основных отделах: в поясничном отделе позвоночника и в бедре. Плотность кости у женщин в постменопаузе оценивается по значению Т-критерия измеренного в стандартных отклонениях (SD). Диагноз остеопороза устанавливается при снижении Т-критерия менее -2.5SDв шейке бедра, в бедре в целом и/или в поясничных позвонках (L1-L4/L2-L4).
Какие анализы нужно сдавать после установления диагноза?
К обязательным исследованиям при постменопаузальном остеопорозе относятся: общеклинический анализ крови, биохимический анализ крови (кальций общий, альбумин, креатинин, фосфор, магний, щелочная фосфатаза, АЛТ, АСТ, глюкоза).
В зависимости от клинической картины, врач также может дополнительно назначить анализы на ТТГ, свободный Т4, 25(ОН)-витамин D, паратиреоидный гормон и другие.
Для ранней оценки эффективности проводимого лечения также анализируются показатели костного обмена, выбираемые по усмотрению врача: костно-специфическая щелочная фосфатаза, остеокальцин, N-концевой проколлаген 1-го типа (P1NP), пиридинолин и дезоксипиридинолин, С- и N-концевые телопептиды коллагена 1-го типа (CTX, NTX).
Почему у женщин после менопаузы возникает остеопороз?
Для женщин эстрогены (женские половые гормоны) являются важнейшим фактором поддержания здоровья костной ткани. После наступления менопаузы происходит снижение уровня эстрогенов, что приводит к потере костной плотности: женщины могут потерять до 20% костной плотности в течение первых 5-7 лет после менопаузы.
Каковы признаки или симптомы остеопороза?
Остеопороз зачастую протекает безболезненно и не имеет специфических симптомов и именно низкотравматический перелом может стать первым проявлением заболевания.
Боли в спине или в костях могут стать дополнительным аргументом для оценки риска переломов. Если вы заметили, что рост за жизнь снизился более чем на 4 см или на 2 см и более за последние 1-3 года – это повод заподозрить компрессионные переломы позвоночника и необходимо обратиться к врачу.
Как лечится остеопороз?
Для лечения остеопороза используются препараты двух групп: антирезорбтивные (бисфосфонаты, деносумаб) и анаболические. В большинстве случаев постменопаузального остеопороза используется именно первая группа.
Антирезорбтивные препараты можно принимать внутрь или инъекционно (есть препараты для подкожного или внутривенного введения). Подходящий препарат вам подберёт лечащий врач на основании результатов обследования.
Как долго проводится лечение остеопороза?
Препаратами для приёма внутрь лечение проводится в течение пяти лет, внутривенными бисфосфонатами – три года. Максимально изученная продолжительность непрерывной терапии – десять лет.
Нужно ли принимать кальций и витамин D?
Все препараты для лечения остеопороза необходимо принимать в сочетании с препаратами кальция (500-1000 мг в сутки) и витамина D (минимум 800 МЕ в сутки). Именно такая комбинация является максимально эффективной.
Как предотвратить развитие остеопороза?
Если у вас нет снижения костной плотности, вам подойдут физические упражнения с осевыми нагрузками, такие как ходьба, бег или танцы. Если у вас установлен диагноз остеопороза, вам лучше подойдут умеренные силовые тренировки: пилатес, тайчи, плавание и т.д. В любом случае, следуйте общему правилу – соблюдайте осторожность при любых физических нагрузках и старайтесь проводить их под контролем опытных специалистов. Также вы можете проконсультироваться с врачом для определения подходящих физических нагрузок.
Также женщинам старше 50 лет необходимо получать не менее 800-1000 МЕ в сутки, а ежедневная потребность в кальции составляет 1500 мг.
Кальцитонин: о чем может рассказать анализ, нормальные показатели и причины отклонения
Кальцитонин относится к гормонам, вырабатываемых, в основном, щитовидной железой, и немного тимусом, легкими. Это вещество отличается сложной структурой и состоит из цепочки аминокислот. Кальцитонин участвует в регулировании фосфорно-кальциевого обмена. В медицинской практике он считается онкомаркером, так как с его помощью определяют наличие медуллярной карциномы щитовидной железы — раковой опухоли. Но и многие другие опасные для жизни заболевания могут привести к повышению уровня этого гормона. Поэтому, если в крови обнаруживается содержание кальцитонина, превышающего установленные нормы, нужно срочно записаться на прием к хирургу-эндокринологу и пройти полное обследование.

Зачем нужен кальцитонин?
Главной функцией кальцитонина является обеспечение постоянного баланса кальция в крови. Его действие обычно рассматривается вместе с работой паратиреоидного гормона, который продуцируется в околощитовидных железах и высвобождает кальций из костей, переправляя его в кровь. Для этого паратиреоидный гормон воздействует на особые костные клеточные структуры – остеокласты. Они в свою очередь влияют на кости и вымывают из них кальций в сосуды. Соответственно, его уровень в крови поднимается.
Кальцитонин имеет противоположное действие. Он не дает кальцию вымываться из костной ткани, сохраняя прочность человеческого скелета. При этом кальцитонин регулирует кальциевый метаболизм, активизируя, таким образом, обновление костной ткани.
Метаболизм кальцитонина происходит в почках, поэтому при наличии их поражения, например, при почечной недостаточности, уровень гормона может быть значительно выше установленных норм.
Кальцитонин измеряется в плазме крови, и его показатели обозначаются как пг/ мл (пикограммы на миллилитр). Для мужчин нормой считается показатель от 0, 68 до 32,3 пг/мл, для женщин от 0,1 до 12,9 пг/мл.
Особенностью пептидного гормона является тот факт, что у него отсутствует нижняя граница нормы. Определяют только верхнюю, показатель которой может меняться в зависимости от того, каким способом определяют уровень кальцитонина (иммуноферментным или иммунохемилюминесцентным). В любом случае важно, чтобы полученные показатели не превышали верхний предел, составляющий 100 пг/л.
Повышенным считается показатель кальцитонина больше 100 пг/мл. Если при этом обнаруживается узел или несколько узлов на щитовидке, то с большой вероятностью будет поставлен диагноз медуллярная карцинома. Своевременная диагностика раковой опухоли позволяет провести оперативное вмешательство и остановить распространение метастаз.
Когда требуется сдавать анализ?
Определение показателей кальцитонина и сравнение их с нормами помогает выявить некоторые серьезные заболевания, проследить динамику роста злокачественной опухоли, своевременно назначить лечение и оценить его результативность.
Анализ проводят в следующих случаях:
- Диагностика медуллярной карциномы.
В первую очередь, анализ на кальцитонин врач-эндокринолог назначает пациентам, у которых имеются узловые образования на щитовидной железе. Согласно медицинской статистике у одного человека из 250, имеющих узлы, обнаруживают злокачественную опухоль – медуллярную карциному.
Медуллярная опухоль образуется из злокачественно переродившихся С-клеток щитовидной железы. Она постоянно вызывает рост концентрации кальцитонина в крови, особенно если проводится провокационное введение кальция или пентагастрина. Причем эндокринологи-хирурги утверждают, что даже если биопсия узлов показала их доброкачественный характер, но при этом уровень кальцитонина в крови превышает верхнюю границу, то стоит говорить о возможности перерождения доброкачественной опухоли в карциному щитовидной железы. Поэтому обязательно будет предложена операция по удалению узлов, ведь чем раньше это сделать, тем выше шанс выздороветь.
- Определение наследственного фактора к раку щитовидки.
Обязательно регулярно следует сдавать кровь на уровень кальцитонина, если в семейном анамнезе есть случаи выявления злокачественной опухоли щитовидной железы. Дело в том, что причиной появления медуллярной карциномы считается мутационные процессы в протоонкогене RET. Эта мутация передается по наследству и в 30% случаев провоцирует развитие рака.
- Оценка проведенного лечения по удалению медуллярной карциномы.
Регулярно требуется сдавать кровь на кальцитонин людям, у которых ранее была проведена операция по удалению злокачественной опухоли щитовидной железы. Это поможет выявить возможные рецидивы.
- Контроль выявленной опухоли.
Анализ на содержание кальцитонина раз в квартал или полгода назначают при подтвержденном гистологически медуллярном раке щитовидки для контроля над ростом опухоли, проведенным лечением и для выбора оптимального времени для проведения хирургического вмешательства.
- Обследование на синдром множественной эндокринной неоплазии.
При наличии гиперпаратиреоза или феохромоцитомы определение кальцитонина помогает опровергнуть или подтвердить наличие опухоли эндокринных желез и наследственный аутосомно-доминантный синдром.
- Выявление нарушений кальциевого обмена и связанных с ним заболеваний.
Обязательно назначают анализ на содержание кальцитонина в крови, если пациент регулярно испытывает боли в костях, у него деформируется скелет, имеют место постоянные переломы. Такая симптоматика может свидетельствовать о нарушении кальциевого обмена в организме. Снижение содержания кальция в крови и одновременное увеличение количества фосфатов указывает на развитие гипопаратиреоза.
Помимо этого содержание кальцитонина, значительно превышающего нормальные значения, может указывать на развитие серьезных патологий:
- панкреатит;
- воспаление щитовидной железы;
- болезнь Педжета;
- злокачественные опухоли нейроэндокринной природы;
- увеличение количества С-клеток с образованием опухоли;
- алкогольный цирроз;
- синдром Золлингера-Эллисона (аденома поджелудочной железы);
- злокачественное малокровие, вызванное дефицитом витамина В12;
- уремия;
- ХПН;
- лейкемия;
- опухоли в легких доброкачественного характера;
- незлокачественной опухоли надпочечников (феохромоцитома).
Понижение кальцитонина при наблюдении за ним в динамике чаще всего указывает на усиленные физические нагрузки. Иногда снижение гормона кальцитонина возникает из-за переутомления, недостатка кальцитрола, является следствием удаления щитовидной железы или злокачественных образований на других органах.
Повышение уровня кальцитонина в крови – это тревожный звоночек от организма, который не стоит игнорировать. Чем больше показатель превышает верхнюю границу, тем выше вероятность развития рака щитовидной железы, метастаз, распространившихся на шейные лимфатические узлы. Чем раньше сдать такой анализ, тем проще будет вылечиться, удалив коварную медуллярную карциному. Чаще всего сниженный уровень кальцитонина показывает, что ситуация более позитивная, чем если уровень гормона повышается. И понижение содержания гормона крови не рассматривается врачами как показатель каких-то патологий.


