Свёртываемость крови
Многие начинают бояться тромбов после того, как при сдачи крови из вены медсестра сообщает, что она слишком вязкая. Те же, кто обладает слишком жидкой кровью, успешно наполняющей пробирку, надеются, что застрахованны от тромбоза. Но вязкость и свёртываемость – два совершенно разных понятия, и не всегда одно обуславливает другое.
Какая ты вязкая
Повышенная вязкость крови, из-за которой она становится менее текучей, чаще всего возникает из-за преобладания её форменных элементов над жидкими. Происходит это из-за слишком строгого следования рекомендациям «не есть за 12 часов до сдачи анализа» и из-за решения добавить к этому ограничению ещё одно – не пить. Чтобы уж наверняка. В итоге получается хуже – и кровь плохо течет в пробирку, и некоторые показатели (например, гемоглобин, гематокрит, общее число эритроцитов, лейкоцитов и тромбоцитов) оказываются искусственно завышенными. Поэтому важно помнить: перед сдачей анализов крови нельзя ограничивать себя в жидкости.
Ещё одна частая причина повышенной вязкости – повышенный уровень эритроцитов и гемоглобина, характерный для курильщиков. Ведь чем больше дыма и меньше воздуха человек вдыхает, тем большая концентрация переносчиков кислорода необходима. Формируется их компенсаторное повышение. Поэтому визуально кровь курящих нередко кажется более вязкой.
По свидетельству гематологов, на долю истинных заболеваний (тромбоцитозы, эритроцитозы и т.д.) связанных с повышенной вязкостью крови, приходится незначительное число всех случаев «вязкой крови». И это хорошо видно по обычному общему анализу крови – врач сразу же обратит внимание на слишком высокое число эритроцитов или тромбоцитов.
В норме содержание эритроцитов крови составляет 3,7-5,1, тромбоцитов – 180-320.
Вязкость и свёртываемость – в чём разница?
Наиболее важным показателем является свёртываемость крови. К сожалению, получить точную информацию о свёртываемости, даже, несмотря на уровень развития медицины, бывает непросто. С одной стороны давно известны явные заболевания с нарушением свёртываемости, такие как гемофилия. С другой, немало скрытой патологии, которая может долгое время никак себя не выдавать, но проявившись однажды, быстро привести к тяжёлым последствиям.
Лишь в последние десятилетия исследователи научились выявлять эти проблемы с помощью высокотехнологичных генетических анализов. Учитывая, что по статистике врождённая патология свёртывающей системы крови есть у более 1-3% населения Земли, вполне вероятно, что в будущем эти анализы будут проводить в роддоме каждому новорожденному. И совершено точно тем, кому необходимо назначить те или иные лекарства, способные усилить риск появления тромбов.
Предохранение или опасность?
Например, это очень важно сделать перед назначение гормональных контрацептивов. Их способность усиливать свёртываемость крови и изредка приводить к тромбозам (как выясняется, почти всегда это происходит у женщин, имеющих скрытое нарушение свёртываемости) известна несколько десятилетий. В связи с широким распространением этого метода защиты от нежелательной беременности в наши дни частота тромбозов у молодых, внешне здоровых женщин возросла. При этом, назначая «КОКи» гинекологи нечасто акцентируют внимание пациенток на этой опасности. Их можно понять – осложнение в общей массе нечастое, а лишний раз запугивать пациенток, словно подталкивая их к нежелательной беременности, не хочется. Тем временем наиболее передовые западные коллеги уже включили полное исследование свёртываемости крови в обязательный алгоритм обследования перед назначением гормональных контрацентивов.
Что покажет анализ?
Какие же анализы необходимо сдать, чтобы проверить свёртываемость крови? Самый распространённый и многим привычный анализ – коагулограмма может дать ответ далеко не на все вопросы, особенно в профилактике тромбозов.
Тем не менее, классическая коагулограмма – первый этап скринингового обследования системы свёртываемости. Если она выявит отклонения от нормы, следующим шагом станут более детальные исследования гемостаза – тромбоэластография или тромбоэластометрия. Отдельная история – определение D-димера, мутации Лейдена и других генетических нарушений свёртывания – тесты, выявляющие склонность к образованию тромбов в будущем. Что и в каких случаях необходимо?
Самая распространённая сегодня стандартная коагулограмма включает в себя пять компонентов: ПТИ ( протромбиновый индекс); МНО ( Международное нормализованное отношение. Отражает отношение времени свёртываемости крови пациента к времени свёртывания крови здорового пациента; АЧТВ (активированное частичное тромбопластиновое время. Оценивает время, за которое образуется сгусток крови после присоединения к плазме специальных реагентов), УРОВЕНЬ ФИБРОГЕНА и ТРОМБОЦИТОВ.
При этом АЧТВ информативен лишь у людей, проходящих лечение гепарином, а МНО важен только для людей, постоянно принимающих разжижающие кровь препараты из группы неодикумаринов (варфарин).
Получается, два показателя из пяти не так важны для скрининга. Общее количество тромбоцитов также не всегда показательно, ведь при большинстве коагулопатий изменяется не их число, а прежде всего функциональная активность.
Поэтому наиболее информативным, позволяющий оценить сразу несколько звеньев свёртывания крови – тромбоэластография. Это своего рода детальное наблюдение за формированием кровяного сгустка, и его последующего растворения (лизиса) с построением графиков каждого из этапов. Тромбоэластометрия – другой вариант этого исследования, считающийся ещё более информативным. К сожалению, приборы для проведения этих исследований дороги и требуют специального обучения персонала, поэтому предложить услуги тромбоэластографии может далеко не каждая лаборатория.
Ещё один важный показатель – D-ДИМЕР (это продукт распада фибрина, небольшого фрагмента белка, присутствующего в крови после разрушения тромба).
Он активно используется для определения риска тромбообразования. Те, у кого D-димер даже незначительно повышен, рискуют столкнуться с появлением тромбов значительно больше остальных. Контролировать D-димер необходимо при заболеваниях вен (тромбофлебиты), после проведенных оперативных вмешательств и при выписке из стационара, если вы были долго прикованы к постели. наблюдать за уровнем D-димера полезно во время беременности и при приеме гормональных контрацептивов (риск образования тромбов при наличии мутации Лейдена на фоне приема противозачаточных таблеток возрастает почти в 9 раз). А теперь и во время COVID-19 и несколько недель после выздоровления.
Сегодня в дополнение к определению D-димера появляются генетические тесты на врожденные нарушения свертываемости крови. Самая частая из них – мутация Лейдена, которая встречается у 2–6% европейцев. Наличие дефектного гена в 6–8 раз повышает вероятность венозных тромбов, значительно возрастает риск инфаркта и инсульта. Но и другие мутации, которых сегодня насчитывается более десяти, не менее опасны. При этом вовремя начатая профилактика тромбозов (главным образом постоянный приём антикоагулянтов, исключение некоторых продуктов и лекарств, ношение компрессионного трикотажа при авиаперелётах и работе «на ногах» т.д.) снижает риск опасных осложнений в десятки раз.
Мерцающая проблема
Если со свёртывающей системой всё в порядке, возможной причиной повышения свёртываемости может оказаться аритмия, а именно – мерцание предсердий. По статистике, пароксизмальной (протекающей приступами) или постоянной формой
мерцательной аритмии страдают 2% населения планеты.
Обычно эта проблема появляется после тридцати. Субстрат нарушения — появление патологических завихрений электрического импульса в предсердиях, которые дают миокарду внеочередные электрические стимулы. На медицинском языке это называется механизмом «re-entry» или повторного
входа возбуждения. В результате предсердия превращаются в маслобойку, которая взбивает кровь в тромбы, словно молоко в масло. Ещё больше ситуация ухудшается в случае, когда у человека исходно были те самые нарушения свёртываемости. Тромбы могут образоваться уже через 48 часов после развития приступа и «улететь» в артерии головного мозга, вызвав ишемический инсульт, в кишечник, приведя в мезентериальному тромбозу, в артерии конечностей, спровоцировав их острую ишемию.
Фактор Виллебранда и COVID-19.
Тяжёлое течение COVID-19 может быть связано с повышенным уровнем одного из факторов свёртывающей системы крови – фактором Виллебранда. Такую гипотезу выдвинула старший научный сотрудник лаборатории биологии амилоидов СПбГУ Анна Аксёнова. Ее научная статья опубликована в журнале «Экологическая генетика». Уже доказано, что вирус SARS-Cov-2 способен оказывать прямое повреждающее воздействие на внутреннюю стенку сосудов. В ответ на повреждение организм стремится как можно быстрее «залатать» пробоину, и ведущую роль в этом играет фактор Виллебранда, участвующий в активации тромбоцитов и, по сути, запускающий процесс местного тромбообразования. В ходе исследований выяснилось, что для некоторых людей характерна повышенная концентрация этого фактора в клетках, так, его, как правило, больше у людей со II группой крови. Также возможна индивидуальная особенность организма. В результате в ответ на массивное микроповреждение сосудов возникает массивный микротромбоз, который вызывает появление более крупных и опасных тромбов.
Генетические мутации системы свёртывания, выявляемые в ходе анализов:
МУТАЦИЯ V КОАГУЛЯЦИОННОГО ФАКТОРА СВЁРТЫВАЕМОСТИ КРОВИ (ФАКТОР ЛЕЙДЕНА)
ИНГИБИТОР АКТИВАТОРА ПЛАЗМИНОГЕНА 1
МУТАЦИЯ II КОАГУЛЯЦИОННОГО ФАКТОРА (МУТАЦИЯ ПРОТРОМБИНА)
МУТАЦИЯ МЕТИЛЕНТЕТРАГИДРОФОЛАТРЕДУКТАЗЫ (MTHFR C677T)
МУТАЦИЯ VII КОАГУЛЯЦИОННОГО ФАКТОРА СВЁРТЫВАЕМОСТИ КРОВИ (F7 ARG353GLN)
ПОЛИМОРФИЗМ ГЕНА РЕДУКТАЗЫ МЕТИОНИНСИНТАЗЫ (MTRR A66G)
МУТАЦИЯ ФИБРИНОГЕНА, БЕТА (FGB G-455A)
МУТАЦИЯ ПРОМОТОРА ГЕНА КОАГУЛЯЦИОННОГО ФАКТОРА FVII (-312 INS 10BP)
ИНСЕРЦИЯ/ДЕЛЕЦИЯ ALU-ЭЛЕМЕНТА В ГЕНЕ АНГИОТЕНЗИН-ПРЕВРАЩАЮЩЕГО ФЕРМЕНА (ALU INS/DEL)
МУТАЦИЯ ТРОМБОЦИТАРНОГО ГЛИКОПРОТЕИНА 1B, АЛЬФА СУБЪЕДИНИЦЫ
МУТАЦИЯ АДФ-РЕЦЕПТОРА ТРОМБОЦИТОВ (P2RY12 H1/H2)
МУТАЦИЯ A1298С ГЕНА МЕТИЛЕНТЕТРАФОЛАТРЕДУКТАЗЫ
D-димер значительно повышается у большинства больных со среднетяжёлым и тяжёлым течением COVID-19. Поэтому все пациенты получают лечебные дозы антикоагулянтов.
Мутация Лейдена – наиболее частое скрытое нарушение свёртываемости крови, встречается у 2-6% европейцев.
Свертывание крови. Схема свертывания крови
Ткани и органы. Кровь
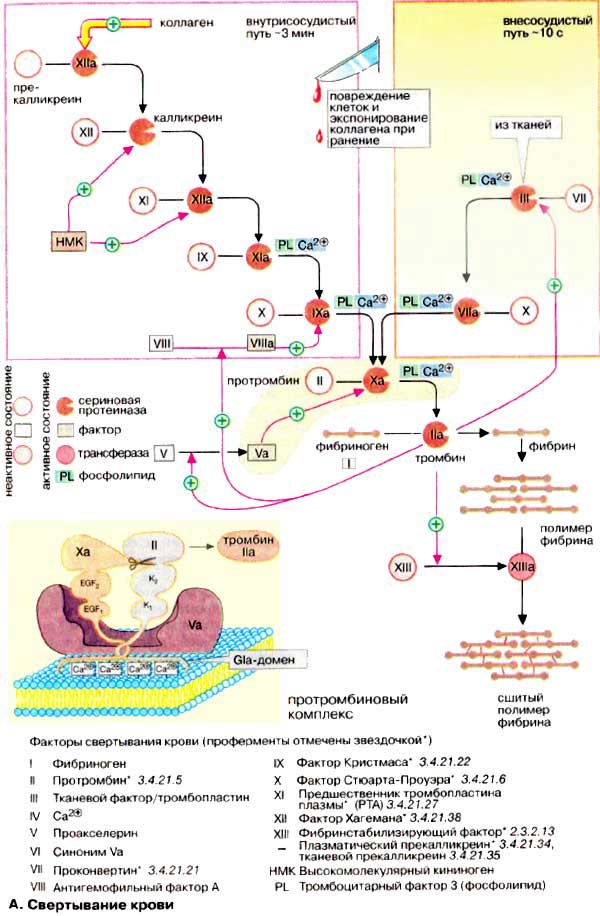
При нарушении целостности кровеносной системы уменьшение кровопотери обеспечивает система гемостаза. Гемостаз поддерживается двумя путями: остановкой кровотечения с помощью тромбоцитов и свертыванием крови . В данном разделе основное внимание уделено ферментативным реакциям свертывания крови. Повторное растворение сгустков крови, фибринолиз , рассмотрен на с. 284.
Номенклатура факторов свертывания крови несколько запутана. Факторы нумеруются римскими цифрами, при этом активированная форма фактора в наименовании содержит дополнительно букву «а» после римской цифры. Многие факторы являются протеиназами. На схеме неактивные предшественники протеиназ представлены в виде окружностей, а активные ферменты — окрашенными кружочками с вырезанным сектором. Вспомогательные факторы показаны в виде прямоугольников.
При свертывании крови происходит ферментативное превращение растворимого белка плазмы фибриногена (фактора I, см. рис. 71) в фибриновый полимер, сеть волокон нерастворимого белка. В этой реакции принимает участие фермент тромбин (фактор IIа), который протеолитически отщепляет от молекулы фибриногена небольшой пептидный фрагмент, в результате чего освобождаются участки связывания, что позволяет молекуле фибрина агрегировать в полимер . Затем с помощью глутамин-трансферазы (фактора XIII) образуются изопептидные связи боковых цепей аминокислот фибрина, что приводит к формированию нерастворимого фибринового сгустка (тромба).
Свертывание крови может запускаться двумя различными путями: вследствие нарушения целостности ткани ( внесосудистый путь, на схеме справа) или процессами, которые начинаются на внутренней поверхности сосуда ( внутрисосудистый путь , на схеме слева). В обоих случаях запускается каскад протеолитических реакций: из неактивных предшественников ферментов (зимогенов, условно обозначаемых на схеме окружностями) путем отщепления пептидов образуются активные сериновые протеиназы (обозначаемые на схеме окрашенными кружочками с вырезанным сектором), которые в свою очередь действуют на другие белки. Оба реакционных пути нуждаются в ионах Са 2+ и фосфолипидах [ФЛ (PL)] и оба завершаются активацией фактором Ха протромбина (фактора II) с образованием тромбина (IIа).
Внутрисосудистый путь инициируется коллагеном, который в норме не экспонирован на внутренней поверхности кровеносных сосудов; его контакт с кровью приводит к активации фактора XII. Внесосудистый путь активации начинается с освобождения фактора III (тканевого тромбопластина) из поврежденных клеток ткани. В течение нескольких секунд этот фактор приводит к свертыванию крови в области раны.
Факторы свертывания II, VII, IX и X содержат необычную аминокислоту, γ-карбоксиглутаминовую (Gla). Остатки Gla, которые образуются в результате посттрансляционного карбоксилирования остатков глутаминовой кислоты, группируются в особых белковых доменах. Они присоединяют ионы Са 2+ и вследствие этого связывают соответствующие регуляторные факторы с фосфолипидами на поверхности плазматической мембраны. На рисунке это схематически представлено на примере протромбинового комплекса (Va, Ха и II). Вещества, способные связывать свободные ионы Са 2+ в виде комплекса, например цитрат, предотвращают это взаимодействие с фосфолипидами и тормозят свертывание. Для синтеза остатков Gla необходим в качестве кофактора витамин К (см. с. 342). Антагонисты витамина К, такие, как дикумарин, подавляют синтез активных факторов коагуляции и действуют поэтому также как ингибиторы свертывания.
Генетически обусловленный дефицит отдельных факторов свертывания приводит к кровоточивости (гемофилия).
Контроль за свертыванием крови (не показан на схеме). Процесс свертывания крови находится в постоянном равновесии между активацией и торможением. Для торможения в плазме имеются очень эффективные ингибиторы протеиназ. Сериновые протеиназы системы свертывания инактивируются антитромбином. Его действие усиливается сульфатированным глюкозаминогликаном — гепарином (см. с. 336). Тромбомодулин, расположенный на внутренней стенке кровеносных сосудов, инактивирует тромбин, образуя с ним стехиометрический комплекс. За протеолитическое разрушение факторов V и VIII в плазме отвечает белок с. Этот белок в свою очередь активируется тромбином и, тем самым, реализуется самотормозящийся механизм свертывания крови.
Система гемостаза
Система гемостаза – одна из важнейших систем жизнеобеспечения организма. Она отвечает за тонкое равновесие в кровеносной системе: обеспечивает свертываемость крови, т.е. не дает человеку умереть от кровопотери при нарушениях целостности сосудистой системы, поддерживает кровь в жидком состоянии и растворяет тромбы, которые выполнили свою задачу.
Гемостаз объединяет нескольких систем, которые обеспечивают баланс между образованием тромбов и их растворением. При наличии проблем в любой из них может возникнуть тромбоз (образование тромбов, препятствующих свободному потоку крови по кровеносной системе) или кровоизлияние (выхождение крови из сосудов). Оба состояния могут быть опасны для жизни.
Исследование системы гемостаза назначается беременным женщинам, перед хирургическими вмешательствами, при назначении гормональных препаратов женщинам старше 35 лет, пациентам с болезнями печени и системы кровотворения.
Основные параметры для контроля системы гемостаза:
Система гемостаза (скрининг) – ключевой тест состояния системы свертывания.
D-димер (D-dimer) – обнаруживается в крови после того, как разрушается тромб. Повышенные значения могут говорить об активном процессе тромбообразования.
Фибриноген (Fibrinogen) – один из ключевых показателей свертываемости крови.
Растворимые фибрин-мономерные комплексы (РФМК) – оценка риска внутрисосудистого тромбообразования.
Активированное частичное тромбопластиновое время (Activated Partial Thromboplastin Time) – оценка времени, за которое образуется тромб.
Протромбин (Prothrombin) , Международное нормализованное отношение, МНО (International Normalized Ratio, INR) – оценка состояния свертывающей системы.
ВАЖНО! В некоторых случаях врач может назначить дополнительные исследования, напрямую не ассоциированные с системой свертывания крови, но имеющие важное диагностическое значение для различных патологий и состояний.
Биохимическое обследование крови>>
Биохимическое обследование крови позволяет оценить общее состояние организма и на ранних стадиях предположить наличие серьезных заболеваний, например, сахарного диабета, гепатита или злокачественных новообразований различной локализации. Вместе с исследованием гемостаза позволяет выявить проблемы практически всех органов и систем.

Диагностика ЖДА>>
Железодефицитная анемия (ЖДА) — самый распространенный вид анемии и самая частая патология кровеносной системы. В группе риска находятся женщины репродуктивного возраста, беременные, дети первого года жизни, а также пациенты старше 65 лет. Известно, что у пациентов с ЖДА повышен риск к тромбообразованию. Поэтому этот анализ имеет важное диагностическое значение при оценке системы гемостаза.

Витамин В12>>
Витамин В12 играет важную роль в метаболизме. Известно, что его дефицит или избыток может сказываться на гемостазе. Например, при гемофилии, вызванной избытком гепариноподобных веществ, витамин В12 нормализует их величину.

Витамин К>>
Получил название от слова koagulation, что означает свертывание, поэтому можно догадаться о важности данного элемента для процесса коагуляции. Если витамин в недостатке, повышается риск развития кровотечений. Кроме он нужен для поддержания прочности сосудистой стенки и ускорении заживления ран.
Вы можете сдать эти анализы в офисе LabQuest или в любом удобном месте, вызвав медицинскую сестру на дом.
Гемостазиограмма / коагулограмма
Свертывание крови осуществляют 13 белков-ферментов, которые называют факторами свертывания крови. Процесс свертывания имеет несколько стадий и состоит в превращении неактивного фактора (профермента) в активную форму – фермент, который катализирует превращение следующего профермента в фермент и т.д. Часто этот процесс называют каскадом свертывания.
Каскад свертывания крови принято условно разделять на два пути – внутренний и внешний. Для активации свертывания крови по внешнему пути необходим тромбопластин (тканевой фактор), который отсутствует в крови в норме и появляется только при повреждении тканей. Компоненты внутреннего пути свертывания присутствуют в крови.
Скрининговые тесты
Исследования гемостаза включают протромбиновое время (ПТВ, PT) с МНО, АЧТВ, тромбиновое время (ТВ, TT), фибриноген.
Скрининговые тесты позволяют исследовать активацию ряда реакций каскада гемостаза. Нормальные результаты этих тестов позволяют исключить нарушения системы гемостаза. Отклонения от нормальных результатов одного или нескольких тестов, могут подсказать направление поиска патологии. Кроме того, скрининговые тесты используют для контроля антикоагулянтной терапии.
Протромбиновое время и АЧТВ часто называют «глобальными» тестами. Они отражают активацию по внешнему и внутреннему пути свертывания крови. Нормальные результаты этих тестов позволяют исключить значительные дефекты большинства компонентов системы свертывания крови.
Протромбиновое время является одним из наиболее часто выполняемых коагулологических анализов. Он был предложен Quick A.J. и соавт. в 1935 г.. Результат теста отражает “внешний” путь свертывания крови и зависит от:
- содержания факторов VII, X, V, протромбина и фибриногена;
- наличия патологических ингибиторов: полимеризации фибрина (ПДФ, миеломные белки), фосфолипид-зависимых реакций.
Существует два стандартных способа представления результатов этого теста.
- % по Квику отражает содержание факторов свертывания.
- МНО – международное нормализованное отношение используют для контроля за антикоагулянтной терапией.
Активированное частичное тромбопластиновое время (АЧТВ) является тестом на “внутренний” путь свертывания и зависит от всех факторов, за исключением VII и XIII. Его удлинение наблюдается при:
- дефиците/аномалии факторов;
- терапии гепарином и, в меньшей степени, антагонистами витамина К;
- наличии патологических ингибиторов
- полимеризации фибрина (ПДФ, миеломные белки)
- инактивирующих факторов.
АЧТВ часто используется в клинической практике для контроля гепаринотерапии.
Тромбиновое время определяют, если ПТВ и АЧТВ выше нормальных значений. Удлинение тромбинового времени наблюдается при:
- аномалии фибриногена (гипофибриногенемия, дисфибриногенемия);
- антикоагулянтной терапии гепарином или прямыми ингибиторами тромбина
- наличии патологических ингибиторов полимеризации фибрина (продуктов деградации фибриногена/фибрина, аномальных антикоагулянтов (миеломных белков).
Фибриноген является важным фактором риска появления тромбозов. Повышение уровня фибриногена наблюдается при курении, при сахарном диабете; уровень фибриногена выше у пожилых людей и лиц, подверженных стрессам, социальной изоляции. Кроме того, фибриноген является белком острой фазы и повышается при воспалительных заболеваниях различной этиологии.
Диагностика волчаночного антикоагулянта (ВА)
Согласно подкомитету по волчаночному антикоагулянту ISTH, существуют следующие критерии диагностики ВА:
- удлинение, как минимум, одного из фосфолипид-зависимых скрининговых коагуляционных тестов;
- отсутствие коррекции удлинения теста при смешивании исследуемого образца с нормальной плазмой;
- коррекция удлинения теста при избытке фосфолипидов;
- отсутствие специфических ингибиторов любых факторов свертывающей системы крови.
Сложность диагностики ВА в том, что не существует “золотого стандарта” анализа ВА, т.е. нет ни одного метода, который обеспечивал бы близкую к 100% чувствительность тестов. Это обусловлено разнообразием свойств образующихся антител, которые теоретически могут ингибировать любую из фосфолипид-зависимых реакций.
Скрининговые тесты для диагностики ВА:
- АЧТВ, чувствительное к ВА;
- Тест с разбавленным тромбопластином (ингибирование тромбопластина);
- Тест с ядом гадюки Рассела
- Каолиновое время
Эти тесты обладают высокой чувствительностью к ВА. У разных фирм-производителей они могут встречаться под разными названиями.
В Лаборатории ЦИР определение Волчаночного антикоагулянта проводится тестом с ядом гадюки Рассела.
Удлинение ПТВ и АЧТВ при нормальном ТВ можно рассматривать, как подозрение на ВА. Аномальный результат хотя бы одного из этих тестов, требует перехода к подтверждающим тестам, которые должны показать или исключить связь с зависимостью от фосфолипидов. Для этого плазмы больного и нормальная (пул донорских) смешивают в равной пропорции и повторяют тесты, результаты которых отличались от нормы у пациента. Если полученный результат превышает средние значения теста на 2-3 стандартных отклонения, то тест на ВА считается положительным. После этого необходимо провести подтверждающие тесты с фосфолипидами. Для этого плазму больного смешивают с синтетическими фосфолипидами или лизатом тромбоцитов в равных пропорциях. Нормальный результат теста подтверждает присутствие в плазме ВА.
Специальные методы исследования компонентов системы гемостаза
Д-димер (D-димер, ДД). Определение уровня Д-димера является высокоспецифичным и чувствительным маркером тромбообразования. Однако его уровень повышается и при патологических состояниях, сопровождающихся усиленным фибоинолизом: геморрагические осложнения, инфекции, заживлении ран, при наличии в крови ревматоидного фактора и т.п. Тем не менее определение Д-димера имеет важное диагностическое значение в диагностике тромбозов. Его уровень позволяет с точностью 98% исключить состояния, сопровождающиеся повышенным тромбообразованием.
Антитромбин III и протеин С являются представителями противосвертывающей системы.
Антитромбин III. Дефицит ATIII может быть наследственным или приобретенным. Наиболее частым клиническим проявлением наследственного дефицита ATIII является развитие тромбоза глубоких вен и, как следствие этого, тромбоэмболии легкого. Вероятность развития тромботических осложнений у больных с дефицитом ATIII увеличивается с возрастом.
Приобретенный дефицит ATIII может быть обусловлен сниженным синтезом, повышенным потреблением или потерей белка. Во всех этих случаях наблюдается параллельное снижение концентрации и активности ATIII. ATIII синтезируется в печени, поэтому некоторые заболевания печени, приводят к снижению уровня ATIII. Если параллельно со снижением ATIII происходит повышение тромбогенных свойств стенки сосудов и активация свертывания, то наблюдается дальнейшее снижение ATIII обусловленное его потреблением, что встречается при ДВС-синдроме, вызванном различной патологией: при массивных травмах, сепсисе, воспалениях ран, змеиных укусах, осложненной беременности, раке и т.д.
Кроме того, снижение синтеза ATIII наблюдается при терапии эстрогенами и синтетическими препаратами, обладающими эстрогенным действием, нефротическом синдроме и желудочно-кишечных заболеваниях, когда потеря белка превышает скорость его синтеза. В этих случаях наблюдается параллельное снижение ATIII и альбумина.
Протеин С. Дефицит ПрС является фактором, предрасполагающим к развитию венозных тромбозов, развивающихся при наличии других осложняющих факторов, таких как травмы, операции и иммобилизация больного, беременность и использование оральных контрацептивов. Приобретенный дефицит ПрС наблюдается при беременности и приеме гормональных контрацептивов, заболеваниях печени и ДВС.
Как тромбоциты ускоряют свёртывание крови


Если посмотреть на каплю крови в микроскоп (пусть это будет световой микроскоп, но достаточно мощный), то можно увидеть клетки трёх типов: многочисленные эритроциты, или красные кровяные тельца, немногочисленные, но довольно крупные лейкоциты и мельчайшие тромбоциты, которые удаётся разглядеть с некоторым трудом. Эритроциты, плотно набитые белком гемоглобином, переносят кислород: гемоглобин связывает его в лёгких и отдаёт в тканях и органах, которые в нём нуждаются. Лейкоциты — клетки иммунной системы, и они вместе с иммунными белками защищают нас от инфекций и от некоторых неинфекционных заболеваний, например от рака. Лейкоцитов существует несколько типов, отличающихся в том числе и по численности; возможно, из лейкоцитов нам попадутся Т-лимфоциты, которые целенаправленно распознают и сами уничтожают как чужеродные, так и наши собственные клетки, которым не повезло заболеть. Наконец, тромбоциты. Про тромбоциты мы знаем, что они нужны для свёртывания крови.
Кто не представляет, как работает система свёртывания крови? Уколовши палец, мы наблюдаем, как он сначала кровоточит, а потом перестаёт — образовавшийся тромб остановил кровь. Если бы кровь не свёртывалась, то разбитый нос мог бы оказаться смертельным ранением. Но, наверно, едва ли не более важная функция механизма свёртывания — предотвращение внутренних кровотечений, которые часто случаются при различных заболеваниях (например, при тяжёлой инфекции или при злокачественной опухоли). При этом система свёртывания должна быть очень точно сбалансирована: если она будет работать плохо, то пойдут неостанавливаемые кровотечения, внутренние и наружные; если же механизм свёртывания будет слишком активным, начнут формироваться тромбы, грозящие закупоркой сосудов и остановкой кровоснабжения. В медицине есть масса примеров, когда процессы свёртывания крови и тромбообразования идут не так, как надо, и не там, где надо. Причиной тому могут быть либо другие болезни, и тогда нарушения системы свёртывания крови — это просто сопутствующий симптом, либо же сами эти нарушения представляют собой отдельные, самостоятельные заболевания (вроде небезызвестной гемофилии или болезни Виллебранда).
Бороться с аномалиями системы свёртывания можно по-разному, и сейчас есть медицинские средства, которые позволяют эффективно регулировать её работу. Но чтобы такие средства работали ещё лучше, чтобы сделать их ещё более совершенными, нужно как можно точнее знать, как на молекулярно-клеточном уровне устроен механизм свёртывания крови. Его изучают уже более ста лет, и сейчас его схему можно найти в любом школьном учебнике; правда, схему эту большинство из нас старается забыть, как страшный сон: ещё бы, около двух десятков белков, соединённых стрелками, — кто-то кого-то активирует, кто-то кого-то ингибирует. Однако если рассматривать свёртывание по этапам, то всё становится более или менее понятно.
Стоит сразу сказать, что собственно свёртывание — лишь часть более общего процесса гемостаза (от греч. haimatos — кровь, stasis — остановка). И этот процесс начинается как раз с тромбоцитов. Они происходят от мегакариоцитов — гигантских клеток костного мозга. От зрелых мегакариоцитов «отшнуровываются» куски цитоплазмы, которые и становятся безъядерными клетками тромбоцитами (хотя, учитывая их происхождение и отсутствие ядра, более корректно называть их просто тельцами крови или кровяными пластинками). Тромбоциты циркулируют по крови, пока не «заметят» брешь в сосуде. Сигналом для них служит соединительнотканный белок коллаген. Он обычно спрятан внутри стенки сосуда, но при её повреждении оказывается лицом к лицу с тромбоцитами и другими белками крови. На мембране тромбоцитов есть специальный рецептор, который хватает коллаген и заставляет кровяные пластинки прилипнуть к месту повреждения. Тут в дело вступает один из факторов свёртывания под названием «фактор фон Виллебранда». Это гликопротеин (его молекула состоит из белковой и углеводной частей), который помогает другим рецепторам тромбоцитов зацепиться за торчащий из стенки сосуда коллаген. Благодаря фактору фон Виллебранда тромбоциты не только прочнее взаимодействуют с местом повреждения, но и дополнительно активируются — подают молекулярные сигналы другим тромбоцитам и белкам свёртывания, меняют внешнюю форму и активно слипаются друг с другом. В результате на стенке кровеносного сосуда появляется затычка из тромбоцитов.
Одновременно с формированием тромбоцитарной пробки происходит процесс собственно свёртывания крови — свёртывания в строгом смысле слова. В нём участвует множество белков плазмы крови, большинство из них — ферменты-протеазы, то есть белки, отщепляющие куски от других белков. Если до расщепления «жертва» протеазы была неактивным белком-ферментом, то после расщепления фермент активируется и, если он сам протеаза, тоже может кого-то расщепить. Суть ферментативных реакций, которые идут во время свёртывания, в том, что белки активируют друг друга, и в итоге всё заканчивается появлением активного белка фибрина, который быстро полимеризуется, превращаясь в нити — фибриллы. Из нитей фибрина формируется фибриновый сгусток, дополнительно укрепляющий тромбоцитовую «затычку», — образуется тромбоцитарно-фибриновый тромб. Когда сосуд восстанавливается, тромб рассасывается.
Оба этапа — и формирование тромбоцитарной пробки, и свёртывание крови с участием плазматических факторов-ферментов — подчиняются множеству регуляторов. Для организма важно, чтобы система гемостаза работала как можно более точно, и многостадийность как раз помогает выполнять тонкую настройку: на каждом этапе, на каждой реакции ферменты и другие молекулы, задействованные в процессе, проверяют, не ложный ли сигнал к ним пришёл и действительно ли есть необходимость в тромбе. Естественно, тромбоциты и факторы свёртывания теснейшим образом связаны друг с другом и тромбоциты нужны не только для того, чтобы первыми заткнуть брешь в сосуде. Во-первых, они также выделяют белки, которые ускоряют восстановление стенки сосуда. Во-вторых, что особенно важно, кровяные пластинки нужны ещё для того, чтобы ферменты свёртывания продолжали работать.
После запуска процесса гемостаза мембрана некоторых тромбоцитов изменяется особым образом, так что теперь на неё могут садиться ферменты реакций свёртывания: после приземления на такие тромбоциты они начинают работать намного быстрее. Что при этом происходит, удалось выяснить лишь относительно недавно. Активированные тромбоциты, то есть те, которые почувствовали повреждение сосуда, бывают двух форм: простые (агрегирующие) и сверхактивированные (прокоагулянтные). Простые агрегирующие тромбоциты отчасти похожи на амёбы: они образуют выпячивания мембраны, похожие на ножки, которые помогают им лучше сцепляться друг с другом, и становятся более плоскими, как бы растекаясь по поверхности. Такие клетки формируют основное тело тромба. Сверхактивированные тромбоциты ведут себя иначе: они приобретают сферическую форму и увеличиваются в несколько раз, становясь похожими на воздушные шарики. Они не просто укрепляют тромб, но и стимулируют реакцию свёртывания, почему их и называют прокоагулянтными.


Почувствовав, что стенка кровеносного сосуда повреждена, тромбоциты активируются. Обычные активированные тромбоциты (слева; фото со сканирующего электронного микроскопа) делаются плоскими и образуют, подобно амёбам, многочисленные выросты мембраны; сверхактивированные, или прокоагулянтные, тромбоциты (справа; фото с просвечивающего электронного микроскопа) превращаются в шар и становятся площадкой для сборки и активации ферментативных комплексов аппарата свёртывания крови. Фото Михаила Пантелеева, МГУ
Как одни тромбоциты становятся простыми, а другие — сверхактивированными? Известно, что в прокоагулянтных тромбоцитах очень высок уровень кальция (ионы кальция вообще один из главных регуляторов гемостаза) и что у них выходят из строя митохондрии. Связаны ли эти изменения в клеточной физиологии со сверхактивацией тромбоцитов?
В прошлом году Фазли Атауллаханов * , директор Центра теоретических проблем физико-химической фармакологии РАН, вместе с Михаилом Пантелеевым, заведующим лабораторией молекулярных механизмов гемостаза центра и профессором кафедры медицинской физики физического факультета МГУ, опубликовали в журнале Molecular BioSystems статью с описанием модели митохондриального некроза как особой формы клеточной смерти. Мы знаем, что клетка может погибнуть в результате апоптоза, включив программу самоуничтожения (при апоптозе всё происходит по плану и с минимальным беспокойством для клеток-соседей), или в результате некроза, когда гибель случается быстро и незапланированно, например из-за разрыва наружной мембраны или из-за масштабных внутренних неприятностей, вроде вирусной или бактериальной инфекции.

Поперечный срез через митохондрии клетки лёгкого. Митохондрии выглядят как цистерны, окружённые двойной мембраной; поперечные полосы на снимке — впячивания их внутренней мембраны, на которой сидят ферменты энергетического обмена веществ. Фото: Louisa Howard/Wikimedia Commons
В чём особенность митохондриального некроза? Митохондрии, как известно, служат источниками энергии для любой нашей клетки: в митохондриях происходит кислородное окисление «питательных» молекул, а освобождённая при этом энергия запасается в удобной для клетки форме. Побочным продуктом при работе с кислородом оказываются агрессивные кислородные радикалы, которые могут испортить любую биомолекулу. Сами митохондрии стараются уменьшать концентрацию радикалов и не выпускать их из себя в клеточную цитоплазму.
При митохондриальном некрозе происходит следующее: митохондрии вбирают в себя кальций, и в какой-то момент, когда кальция становится слишком много, они разрушаются, выплёскивая в цитоплазму и кальций, и активные формы кислорода. В результате в клетке распадается внутриклеточный белковый скелет и клетка сильно увеличивается в объёме, превращаясь в шар. (Как мы помним, шарообразная форма характерна для сверхактивированных тромбоцитов.) Кроме того, и ионы кальция, и активные формы кислорода активируют фермент скрамблазу, который перебрасывает фосфатидилсерин — один из липидов цитоплазматической мембраны — из внутреннего слоя мембраны в наружный. И вот на такую модифицированную мембрану округлившихся тромбоцитов, обогащённую фосфатидилсерином, прилипают некоторые важные факторы свёртывания: здесь они собираются в комплексы, активируются, и в результате реакция свёртывания ускоряется в 1000–10 000 раз.
В новой статье, опубликованной в июне этого года в Journal of Thrombosis and Haemostasis, Михаил Пантелеев, Фазли Атауллаханов и их коллеги описывают эксперименты, которые полностью подтверждают такую модель активации тромбоцитов: кровяные пластинки стимулировали тромбином, одним из белков системы свёртывания, после чего митохондрии наполнялись ионами кальция, а в митохондриальных мембранах появлялись поры. Проницаемость митохондрий увеличивалась, и в какой-то момент, когда изменение проницаемости делалось необратимым, весь запасённый кальций оказывался в цитоплазме и запускал процесс «переформатирования» наружной мембраны.
Получается следующая картина: тромбоциты, подчиняясь внешним активаторам, впитывают кальций. Из их цитоплазмы кальций переходит в митохондрии. В самой цитоплазме уровень ионов кальция то повышается, то понижается (осциллирует), но в митохондриях он неуклонно растёт, и наступает момент, когда они уже не могут удерживать кальциевые ионы внутри себя. Весь кальций (с кислородными окислителями) выходит в цитоплазму и включает фермент, перебрасывающий липиды в цитоплазматической мембране тромбоцита. В результате на поверхности сверхактивированного и, очевидно, доживающего свои последние минуты тромбоцита собираются ферментативные комплексы, ускоряющие реакцию свёртывания.
Почему же не все тромбоциты становятся сверхактивированными — прокоагулянтными? Вероятно, потому, что для активации требуется сумма сигналов от разных регуляторов. Мы уже сказали, что тромбоциты чувствительны к тромбину, который плавает в плазме крови, а в начале статьи говорили, что одним из первых активирующих сигналов для кровяных пластинок служит коллаген из повреждённой стенки сосуда. Коллаген и тромбин действительно сильные активаторы, но кроме них тромбоциты «прислушиваются» и к некоторым другим молекулам. Степень активации зависит от количества разных входных сигналов, и превращение в прокоагулянтную форму, очевидно, происходит тогда, когда суммарный сигнал извне оказывается для конкретного тромбоцита особенно сильным.
Практические аспекты полученных результатов понятны каждому: чем больше подробностей узнаем про свёртывание крови, тем скорее научимся управлять этим процессом, ускоряя или замедляя его в соответствии с медицинскими показаниями.
Физиология человека и животных
Свертывающая и противосвертывающая системы крови. Плазменные и клеточные факторы свертывания
Гемостаз – остановка кровотечения. Это защитная реакция организма при повреждении стенки сосуда, проявляющаяся в спазме кровеносных сосудов и появлении тромба – кровяного сгустка. В реакции гемостаза принимают участие окружающая сосуд ткань, стенка сосуда, плазменные факторы свертывания, тромбоциты и биологически активные вещества.
В интактном организме факторы свертывания находятся в неактивном состоянии. При повреждении сосуда вытекающая из него кровь начинает сворачиваться, образуя через 3 – 4 минуты плотный сгусток. Свертывание связано с превращением находящегося в плазме крови растворимого белка фибриногена в нерастворимый фибрин. Процесс свертывания крови протекает с участием веществ, находящихся в плазме крови (плазменные факторы), а также тромбоцитарных, тканевых и лейкоцитарных (клеточные) факторов.
Плазменные факторы обозначают римскими цифрами от I до XIII в сочетании с буквой F (FI – FXIII – от фибрина до фибринстабилизирующего фактора), а тромбоцитарные арабскими цифрами и буквой Р (РI – РI). Как правило, плазменные факторы – это проферменты, которые синтезируются в печени или эндотелии сосудов и входят в глобулиновую фракцию белков плазмы. В активную форму они переходят в процессе свертывания крови.
Например, фактор I – это фибриноген, фактор II – протромбин, фактор III – тромбопластин, фактор IV – ионы Са 2+ .
Факторы VIII и IX – так называемые антигемофильные факторы, так как при их отсутствии нарушается свертывание крови и развивается гемофилия. Фактор XII – контактный фактор (фактор Хагемана), активность которого повышается при повреждении стенки сосуда.
Клеточные факторы находятся в тромбоцитах и клетках эндотелия и лейкоцитов и обозначаются арабскими цифрами от 1 до 12.
Схема свертывания крови . Повреждение сосуда или клеток крови приводит к активации факторов свертывания, причем активация одного ведет к активации следующего и т.д. и получается каскадная реакция, приводящая к образованию фибриновых нитей и тромба. В зависимости от степени повреждения и вида сосудов, различают два основных механизма гемостаза – сосудисто-тромбоцитарный и коагуляционный .
Сосудисто-тромбоцитарный гемостаз наблюдается в мелких сосудах с низким кровяным давлением. При этом механизме в месте повреждения сосуда наблюдается только I этап гемостаза , на котором происходит активация тромбоцитов и выделение ими в плазму клеточных факторов свертывания. Эти факторы, склеиваясь, образуют рыхлую пробку, которая затем уплотняется, превращаясь в тромб, закрепляющийся в поврежденном сосуде. Выделяющийся из тромбоцитов серотонин способствует спазму сосуда, и таким образом заканчивается кровотечение.
Коагуляционный гемостаз имеет место в более крупных сосудах, при этом включается II этап – ферментативного свертывания крови, который состоит из 3 фаз.
I фаза – образование сложного комплекса – так называемой протромбиназы, из разрушенных форменных элементов крови (прежде всего тромбоцитов) и обломков клеток тканей. Важнейшим фактором, инициирующим запуск гемостаза, является так называемый тканевой фактор, представляющий собой трансмембранный гликопротеин, который после выхода из цитоплазмы на поверхность клеток активирует клетки крови, вызывая их слипание и агрегацию, активирует плазменные факторы свертывания крови (начиная c XII и до IY) и способствует образованию протромбиназы.
II фаза – тромбинообразование, происходит под влиянием протромбиназы и заключается в образовании активного тромбина из протромбина (II фактор).
III фаза – фибринообразование, происходит под влиянием тромбина и приводит к переходу растворимого белка фибриногена (I фактор) в нерастворимый фибрин, образующий фибриновую сеть, в которой задерживаются тромбоциты, лейкоциты, эритроциты и белки плазмы, образуя сгусток, или фибриновый тромб. Тромб – это сгусток, состоящий из нитей фибрина и осевших в них форменных элементов.Затем происходит ретракция сгустка, тромб плотнее закупоривает сосуд и сближает края раны.
Весь процесс гемостаза протекает в течение 3 – 4 минут.
Одновременно с ретракцией, но с меньшей скоростью, начинается фибринолиз – постепенное ферментативное растворение образовавшегося фибрина под влиянием фибринолизина, который в норме находится в плазме в неактивном состоянии. Под влиянием естественных активаторов плазмы он превращается в фибринолизин, растворяющий фибрин. Активаторы фибринолизина возникают в плазме особенно активно после усиленной мышечной работы, эмоций, а также после смерти организма, в результате чего кровь остается жидкой в течение нескольких часов.

Противосвертывающая система крови. Кровь в организме находится в жидком состоянии, хотя в ней есть все компоненты для свертывания. Это объясняется наличием специальных противосвертывающих механизмов.
Противосвертывающие вещества, или антикоагулянты, – это вещества, которые растворяют тромбы или препятствуют свертыванию крови. Они подразделяются на:
– первичные антикоагулянты, самостоятельно синтезируемые в организме: антитромбин, гепарин (содержащийся в базофилах и тучных клетках), протеин С,
– вторичные антикоагулянты, образующиеся в процессе свертывания крови и фибринолиза: фибрин и продукты деградации фибриногена и фибрина.
Неповрежденный эндотелий сосудов также действует как мощная антикоагулянтная система, препятствующая свертыванию крови.
В здоровом организме все три системы – гемокоагуляции, фибринолиза и эндогенных антикоагулянтов – находятся в тесной функциональной взаимосвязи и уравновешивают друг друга, образуя единую систему регуляции агрегатного состояния крови – РАСК, которая находится под контролем нервных и гуморальных механизмов.



