Перспективы противовоспалительной терапии остеоартроза
Остеоартроз является самым распространенным хроническим заболеванием суставов. Главными проявлениями остеоартроза являются боль и ухудшение функции суставов, обусловливающие необходимость лечения. В настоящее время для лечения используются нестероидные противовоспалительные средства, опиоидные анальгетики, глюкозамин и хондроитина сульфат, возможно применение неомыляющихся соединений авокадо и сои. Обсуждается возможность терапии противоостеопоротическими препаратами – бисфосфонатами, кальцитонином, стронция ранелатом.
Остеоартроз (ОА) является самым распространенным хроническим заболеванием суставов, которое встречается примерно у 11–13 % населения земного шара; 81 млн больных ОА зарегистрированы в пяти развитых странах (Германия, Италия, Франция, Великобритания, Испания) и 383 млн больных – в России, Бразилии, Индии и Китае [1]. Значительное увеличение частоты ОА обусловлено прежде всего быстрым постарением популяций и пандемией ожирения, поэтому ОА в настоящее время становится одной из основных проблем здравоохранения практически во всех странах. Прогнозируют, что к 2020 г. встречаемость ОА в популяциях может достичь 57 %, причем существенно увеличиваются затраты на лечение ОА (рис. 1) [2].
Распространенность ОА в России, по данным эпидемиологического исследования (Галушко Е.А., 2011), составила 4,3 %, что превышает официальные данные почти в 2 раза. Число пожилых людей в России приближается к 50 млн. В 2003 г. в России среди лиц старше 60 лет женщины составили 66 %, старше 85 лет – 78 %. Таким образом, к числу престарелых и долгожителей в нашей стране относятся преимущественно женщины. В связи с этим многие хронические заболевания старшего возраста в нашей стране: ишемическая болезнь сердца, артериальная гипертензия, инсульт, сахарный диабет, злокачественные новообразования, деменция, остеопороз и ОА, особенно остро проявляются в женской популяции. Кроме того, установлено, что риск летальности среди больных ОА выше популяционного, он обусловлен не только возрастом и сопутствующей патологией, но и ограничением двигательной активности – следствием непосредственно заболевания.
Вместе с тем только 30 % больных из развитых стран получают лечение.
Оценка выполнения рекомендаций OARSI (Osteoarthritis Research Society International) в общей клинической практике по нефармакологическим и фармакологическим методам лечения пациентов с ОА коленных и тазобедренных суставов, подвергшихся артропластике, показала, что большинством больных эти рекомендации в полном объеме не выполнялись [3]:
• только 43 % получили рекомендации по снижению избыточной массы тела;
• 23–67 % получили рекомендации по выполнению комплекса упражне- ний;
• 55 % получали ацетаминофен;
• 81 % получали слабые опиоидные анальгетики;
• 64 % получали неселективные нестероидные противовоспалительные средства (НПВС), из них 43 % без гастропротекции;
• 5 % получали селективные НПВС;
• 31 % получали сочетание локальных и системных форм НПВС;
• 4 % получали капсаицин;
• 24 % получали глюкозамин и/или хондроитина сульфат;
• 19 % получали глюкокортикоиды внутрисуставно;
• 0 % – гиалуроновую кислоту.
Боль и потеря функции сустава представляют собой главные клинические проявления болезни, приводящие больного к врачу и обусловливающие необходимость лечения. Хорошо известно, что диагноз ОА чаще устанавливается уже не на ранних стадиях процесса, когда трудно ожидать значительного эффекта от препаратов, модифицирующих течение болезни. Несмотря на большие успехи в исследовании маркеров ОА, внедрение новых инструментальных методов диагностики, все еще требуются более чувствительные и специфичные методы для описания патологических механизмов развития ОА, диагностики на ранних стадиях процесса, определения прогноза заболевания и предсказания эффективности проводимого лечения. ОА представляет собой мультифакториальную болезнь, в патогенезе которой играют роль многие эндогенные и экзогенные факторы и действительно последнее определение характеризует ОА как гетерогенную группу заболеваний, имеющих различную этиологию, но одинаковые биологические, морфологические и клинические исходы. Возможно, что лучшее определение ОА с этой точки зрения как совокупность различных фенотипических проявлений заболевания поможет выделить более специфические пути воздействия на патологический процесс, что позволит добиться лучших исходов болезни.
Современные подходы к лечению ОА
В настоящее время основная цель лечения ОА заключается в:
• замедлении прогрессирования ОА;
• снижении риска обострения и вовлечения новых суставов;
• предотвращении развития деформации суставов и инвалидизации пациентов;
• улучшении качества жизни больных;
• уменьшении побочных эффектов фармакотерапии и обострений
• научное подтверждение эффективности с точки зрения медицины, основанной на доказательствах;
• высокий уровень фармацевтического производства препарата (GMP стандарт);
• фармакоэкономические преимущества метода лечения;
• доказательная клиническая практика.
Рис.1 Препараты, используемые для лечения хронических заболеваний суставов
Немедикаментозное лечение ОА
Нефармакологические методы занимают большое место в терапии ОА. В настоящее время активное привлечение больных к управлению симптомами болезни становится составной частью лечебного плана ведения больного с любым хроническим заболеванием. Разработка образовательных программ (методические рекомендации, брошюры для больных, помогающие справляться с болью), организация обществ больных оказались достаточно эффективными в плане уменьшения числа визитов к врачу. Кроме того, при долгосрочном ведении хронического заболевания такие методы повышают комплаентность больных. При ОА существует позитивный опыт применения лечебной физкультуры, различных мероприятий, защищающих сустав, снижающих вес больных (размер эффекта 0,20 – 0,50) (табл. 1). Снижение веса является довольно эффективным методом лечения, особенно при ОА коленных суставов. Рандомизированные контролируемые исследования показали, что снижение веса приводит к уменьшению боли, улучшению функционального состояния суставов [6], положительным структурным изменениям в хряще и позитивным изменениям маркеров хряща и кости [7, 8]. При поражении суставов нижних конечностей для уменьшения нагрузки рекомендуется хождение с палочкой, которая почти на 50 % уменьшает нагрузку на тазобедренный сустав, ношение надколенников и упинаторов. Использование подпяточных клиньев полезно при ОА медиального отдела коленного сустава.
Таблица 1. Сравнение эффекта при различных методах лечения ОА
Рис.2 Симптоматическая терапия ОА
Медикаментозное лечение ОА
Спектр применяемых препаратов в последнее десятилетие значительно расширился (рис. 2). При умеренных болях в суставах первыми назначают анальгетические препараты, например парацетамол. Главное его преимущество заключается, по-видимому, в низкой токсичности для верхних и нижних отделов желудочно-кишечного тракта (ЖКТ), особенно по сравнению с НПВС, которые часто назначаются пожилым людям. Однако при недостаточной эффективности препарата в течение 3–4 недель и наличии признаков воспаления назначаются НПВС, причем для больных ОА, как правило, эффективны более низкие дозы НПВС по сравнению с больными с воспалительными заболеваниями суставов. НПВС используют при ОА различной локализации в наименьшей эффективной дозе и в течение максимально короткого периода времени. При наличии у больного факторов риска побочных реакций со стороны сердечно-сосудистой системы большее значение имеет не класс выбираемого НПВС, а его особенности: использование препаратов с наименьшим риском развития побочных реакций, применение НПВС, сочетающихся с другими лекарственными средствами, необходимыми для терапии сопутствующей патологии, и т. д. При высоком риске развития нежелательных явлений со стороны ЖКТ рекомендуется назначать селективные ингибиторы циклооксигеназы-2 или сочетать неселективные НПВС с приемом ингибиторов протонной помпы.
Масса побочных реакций, особенно со стороны пожилых пациентов, многие из которых принимают препараты по поводу сопутствующих заболеваний и в случаях, когда требуется учитывать взаимодействие препаратов, делают привлекательным использование местных средств для лечения ОА [9]. Используются мази, гели, кремы на основе НПВС, создана форма НПВС в виде пластыря. Такие формы введения НПВС могут иметь преимущества и уменьшить потребность в приеме системных препаратов.
Использование слабых опиоидных анальгетиков при ОА уменьшает боль, но их действие не равноценно анальгетическому эффекту НПВС, кроме того весьма малочисленны данные по их длительному применению [10]. Противоболевой эффект комбинации трамадола и кодеина возрастает, но увеличивается число нежелательных явлений [11].
При ОА, как и при других болезнях опорно-двигательного аппарата, часто определяется повышенное напряжение скелетных мышц – синдром болезненного мышечного спазма, ухудшающее функциональную активность и качество жизни больного. Причем поражение мышцы развивается в результате воздействия биомеханических или воспалительных факторов. Каждое локальное болевое раздражение вызывает спинальный сенсомоторный рефлекс в соответствующем ему сегменте спинного мозга, сопровождающийся активацией мотонейронов, что приводит к спазму мышц, иннервируемых этими нейронами. Далее мышечный спазм в свою очередь приводит к стимуляции болевых рецепторов самой мышцы. Предполагают, что в мышце формируются триггерные точки, содержащие множественные локусы сенситизации, состоящие из одного или нескольких сенситизированных нервных окончаний. Возникает т. н. порочный круг: боль–мышечный спазм–усиленная боль–болезненный мышечный спазм. Следовательно, боль в суставе при ОА обусловлена и структурными изменениями, происходящими в суставе при развитии ОА, и механизмами периферической и центральной боли, поэтому в рекомендации по лечению ОА включаются препараты, воздействующие и на эти механизмы болевого синдрома: миорелаксанты, антиконвульсанты, антидепрессанты.
Так называемые противоартрозные препараты (глюкозамина суль- фат, хондроитина сульфат, диацереин, неомыляющиеся соединения сои и авокадо, препараты гиалуроновой кислоты) в отличие от анальгетиков и НПВС принадлежат к симптом-модифицирующим препаратам замедленного действия. Они характеризуются более медленным развитием симптомомодифицирующего действия, выраженным последействием, когда после прекращения лечения эффект сохраняется еще в течение 4–8 недель и более и самое главное – обладают потенциальным структурно-модифицирующим действием.
Эффективность глюкозамина сульфата и хондроитина сульфата при лечении ОА доказана как в экспериментальных, так и в клинических исследованиях. За последние десятилетия проведено более 20 контролируемых исследований хондроитина сульфата и глюкозамина сульфата при ОА, в которых было продемонстрировано, что симптоматический эффект лечения этими препаратами аналогичен эффекту НПВС и других анальгетиков; при этом их безопасность не отличалась от плацебо. По результатам нескольких многоцентровых двойных слепых плацебо-контролируемых исследований отмечено уменьшение болевого синдрома на фоне приема хондроитина сульфата и глюкозамина сульфата, что позволило снизить потребность в НПВС. В недавних исследованиях продемонстрирован структурно-модифицирующий эффект хондроитина сульфата и глюкозамина сульфата, который выражался в стабилизирующем влиянии препаратов на ширину суставной щели. У пациентов с ОА коленных суставов, наблюдавшихся в течение 2–3 лет, сужение суставной щели на 0,5 мм и более наблюдалось достоверно реже в группе больных, принимавших хондроитина сульфат и глюкозамина сульфат по сравнению с группой плацебо. Помимо этого данным препаратам свойственно наличие последействия, т. е. сохранения клинического эффекта после отмены – от 4 недель до 3 месяцев. Вместе с тем до сих пор отсутствует однозначное признание эффективности этих препар тов при ОА. Одни авторы ссылаются на выраженную гетерогенность и групп больных, включенных в исследования, и оценки исходов заболевания, поэтому мета-анализы существующих работ часто дают неоднозначные результаты. Тем не менее, несмотря на опубликованные рекомендации американской коллегии ревматологов в этом году об отсутствии эффекта от лечения этими препаратами, EULAR опять приводились данные о наличии, например, у хондроитина сульфата как симптоматического, так и структурно-модифицирующего действия, хотя эффект был невыраженным.
Доказанная эффективность глюкозамина сульфата и хондроитина сульфата в виде монотерапии создала предпосылки для разработки комбинированных препаратов. Существуют некоторые позитивные экспериментальные и клинические данные по эффективности комбинации глюкозамина сульфата и хондроитина сульфата. По результатам многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования GAIT (Glucosamine/Chondroitin Arthritis Intervention Trial) было установлено, что у пациентов с интенсивным болевым синдромом (301–400 мм по WOMAC) эффективность комбинированной терапии (хондроитина сульфата и глюкозамина) была достоверно выше по сравнению с плацебо и монотерапией хондроитина сульфатом или глюкозамином. В НИИ ревматологии РАМН также подтверждена эффективность и безопасность применения комбинированной терапии хондроитина сульфата и глюкозамина при ОА коленных суставов. В настоящее время проводится исследование эффективности комбинации хондроитина сульфата и глюкозамина при ОА в четырех странах Европы.
Неомыляющиеся соединения авокадо и сои также рекомендуются для лечения ОА. Они уменьшают боль и улучшают функцию суставов, эффект несколько более выражен для тазобедренных суставов по сравнению с коленными (размер эффекта 0,01–0,78) [12].
Диацереин значительно облегчает симптомы ОА по сравнению с плацебо, имеет примерно равную эффективность с НПВС, но в отличие от них обладает выраженным последействием. Кроме того, не вызывает тяжелых побочных явлений, которые часто регистрируются при приеме НПВС (размер эффекта устранения боли – 0,24; 95 % доверительный интервал – 0,08–0,39) [4].
Эффективность и безопасность препаратов гиалуроновой кислоты показаны во многих плацебо-контролируемых исследованиях. Было отмечено, что гиалуроновая кислота оказывает более длительное действие по сравнению с глюкокортикоид ми. Систематический обзор пяти мета-анализов показал, что препараты гиалуроновой кислоты (и низко, и высокомолекулярные) эффективно уменьшают симптомы при ОА коленных суставов в отношении влияния на боль, припухлость и скованность [13], хотя появляются данные о большей эффективности высокомолекулярных соединений [14].
Последние два десятилетия ведутся поиски возможностей применения противоостеопоротических препаратов лечения ОА, что связано, с одной стороны, с влиянием их на метаболизм субхондральной кости, с другой – с наличием у этих препаратов хондро-протективных свойств. В первую очередь к этим препаратам относят бисфосфонаты и кальцитонин, а в последние годы – еще и стронция ранелат.
Обсуждается несколько механизмов действия данных препаратов при ОА (табл. 2).
Хондропротективный эффект противоостеопоротических препаратов подтверждается анализом уровня продуктов деградации хряща и маркеров костной резорбции в сыворотке крови и моче. Известно, что концентрация фрагментов коллагена II типа, основного коллагена хряща, повышена у больных ОА по сравнению со здоровым контролем. Кроме того, пациентам с прогрессирующим течением гонартроза свойственно повышение экскреции с мочой маркеров костной резорбции (N- и С-концевой телопептиды коллагена I типа, пиридинолин и дезоксипиридинолин).
Начиная с середины 1990-х гг. проводились исследования, изучавшие эффективность применения кальцитонина и бисфосфонатов при ОА; результаты некоторых из них приведены в табл. 3.
Таким образом, бисфосфонаты и кальцитонин являются перспективными препаратами лечения не только ОП, но и ОА.
Таблица 2. Механизмы действия бисфосфонатов и кальцитонина при ОА
Таблица 3. Исследования применения кальцитонина и бисфосфонатов при ОА
Возможно, не менее перспективным направлением в терапии ОА окажется применение стронция ранелата. Всестороннее изучение стронция ранелата позволило установить, что препарат обладает хондропротективными свойствами. В исследованиях invitroбыло обнаружено, что стронция ранелат увеличивает продукцию хрящевого матрикса хондроцитами. Данный эффект был подтвержден лабораторно: содержание С-терминального телопептида коллагена II типа в моче достоверно снижалось в группе больных остеопорозом, принимавших стронция ранелат на протяжении трех лет. Препарату также свойственно анальгетическое действие.
В настоящее время закончено международное двойное слепое плацебо-контролируемое исследование эффективности и безопасности стронция ранелата у для больных ОА коленных суставов.
В исследование были включены 1683 пациента. Предварительные данные свидетельствуют о наличии у препарата симптом- и структурномодифицирующих свойств при ОА коленных суставов.
Показано, что помимо вышеперечисленных препаратов некоторые хондропротекторы также способны изменять метаболизм субхондральной кости, данные свойства обнаружены у хондроитина сульфата.
На протяжении многих десятилетий список лекарственных средств, используемых в лечении ОА, был весьма ограничен. В настоящее время ведутся дальнейшие исследования, появляется большое количество новой информации о различных методах лечения ОА, особенно разработках терапевтических препаратов, действие которых направлено на определенные патогенетические механизмы заболевания, обусловливающие прогрессирование болезни на клиническом и молекулярном уровнях. Все эти данные позволяют надеяться, что и в борьбе с ОА можно будет добиться таких же успехов, какие уже достигнуты при лечении других ревматических болезней.
Остеоартроз – симптомы и лечение
Что такое остеоартроз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Фомичев А. А., ортопеда со стажем в 9 лет.
Над статьей доктора Фомичев А. А. работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Остеоартроз (артроз) — заболевание суставов, характеризующееся дегенеративным изменением покрывающего кость хряща, проще говоря, его разрушением.
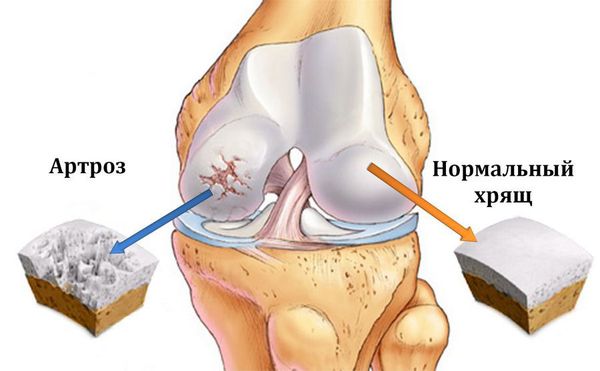
Подавляющее число поражаемых суставов — это коленный, тазобедренный, плечевой и первый плюсне-фаланговый. Поражение других суставов встречается намного реже и часто является вторичным. Остеоартроз поражает 12% трудоспособного населения только европейской части Российской Федерации, причем в последние годы вызванная им нетрудоспособность выросла в 2 раза. [1]
Артрит и артроз: в чём разница
Различий нет, и то и другое название корректное. В зарубежных руководствах болезнь называют остеоартритом (ОА).
Причины артроза
Как и у любого заболевания, у остеоартроза также имеются факторы риска его развития, которые и сегодня активно изучаются, и список ежегодно расширяется. [5]
Основными факторами риска артроза принято считать:
– нарушения обмена веществ;
– повышенный вес тела;
– неполноценное и нерегулярное питание;
– артрит (воспалительный процесс в суставе);
– очаги хронической инфекции или воспаления (например, хронический тонзиллит).
– варикозное расширение вен нижних конечностей.
Артроз у детей
У детей заболевание встречается редко. В основном оно возникает при тяжёлых остеохондропатиях, например при болезни Пертеса, и протекает с сильной болью. Тактика лечения такая же, как у взрослых, но с акцентом на органосохраняющую хирургию.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы остеоартроза
Общие симптомы артроза включают:
- боль во время нагрузок;
- ограничение движений в суставе;
- чувство скованности по утрам, чувство «хруста»;
- боль после долгого отдыха (так называемая «стартовая»).
Суставные боли при артрозе редко бывают острыми, чаще ноющего или тупого характера, как правило, прекращающиеся во время покоя. Симптомы часто носят волнообразный характер, могут возникать и прекращаться без попыток лечения. Они могут быть незначительными, умеренными или тяжелыми. Жалобы при остеоартрозе могут оставаться примерно одинаковыми в течение многих лет, но со временем прогрессируют, и состояние ухудшается. Незначительные и умеренные симптомы возможно контролировать на одном уровне, а вот тяжелое течение заболевания может привести к хронической боли, неспособности выполнять ежедневные бытовые действия, что влечет за собой и потерю трудоспособности, вплоть до инвалидизации.
Патогенез остеоартроза
Основной питательной средой сустава является синовиальная жидкость. Она же выполняет и роль смазывающего агента между суставными поверхностями. Огромную и главную роль в развитии остеоартроза отводят метаболическим процессам в суставе и в его структурах. На начальной стадии, когда развиваются биохимические нарушения в синовиальной жидкости, ее свойства снижаются, что запускает механизм разрушения. Первой под удар попадает синовиальная оболочка сустава, которая выполняет важную роль мембраны и является подобием фильтра для самого главного питательного вещества хряща — гиалуроновой кислоты, не давая ей покинуть ее основное место работы — полость сустава. Насыщенность свойств суставной жидкости определяет ее циркуляция, чего без регулярного движения самого сустава быть не может. Отсюда и известная фраза «движение — это жизнь». Постоянная циркуляция синовиальной жидкости в полости сустава — залог полноценного обмена веществ в нем. При недостатке питательных веществ хрящ истончается, образование новых клеток останавливается, суставная поверхность становится неровной, грубой, с участками дефектов. Известна взаимосвязь между заболеваниями вен нижних конечностей (например, варикоз) и развитием нарушений обмена веществ в суставах, преимущественно коленных. [6] Костная структура, находящаяся под хрящевой, отвечает на процесс компенсаторным механизмом — она утолщается, становится грубее и расширяет зону покрытия, в результате чего образуются экзостозы и остеофиты, что и является основной причиной ограничений и деформаций сустава. Синовиальная жидкость насыщается клетками воспаления и элементами распада, суставная капсула в ответ на это утолщается, становится грубой и теряет эластичность, мягкие ткани буквально становятся сухими (происходит их дегидратация), отсюда и жалобы на утреннюю скованность, «стартовые боли». Патологический процесс в последних стадиях провоцирует организм включить последний компенсаторный механизм — обездвиживание. В состоянии покоя и так называемом физиологическом положении болезненность минимальна, связочный аппарат максимально расправлен. В таком положении сустав стремится зафиксироваться, и ему это удается быстрым образованием более грубых экзостозов, которые «фиксируют» сустав, а пациент при этом теряет способность полноценно двигать им. Мышцы такой конечности гипотрофируются, становятся слабее и меньше. Такие изменения уже считаются необратимыми.
Классификация и стадии развития остеоартроза
Разделяют заболевание на 2 большие группы: первичный (или идиопатический) и вторичный.
Первичная и вторичная форма артроза
Первая группа развивается в результате либо неясной причины, либо в результате возрастных изменений. Вторая характеризуется четкими причинами и развивается в результате их патологического процесса (например, на фоне туберкулеза, рассекающего остеохондрита, субхондрального некроза и т.д.)
Стадии артроза
Независимо от причин, которые явились фактором развития остеоартроза, различаются 4 стадии его развития:
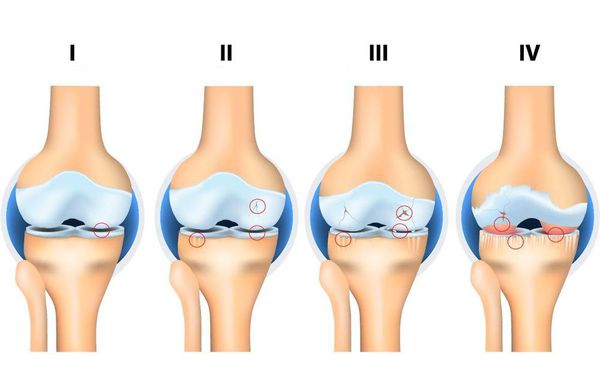
1 стадия: твердые структуры сустава в процесс разрушения не вовлекаются, имеются начальные изменения в его мягких структурах и в составе суставной жидкости (которая является питательной средой и снижающей трение сустава), происходит нарушение питания сустава.
2 стадия: сопровождается «запуском» механизма разрушения твердых структур сустава, образуются краевые твердые образования (экзостозы, остеофиты). Умеренные жалобы на изменения в объеме движений.
3 стадия: сопровождается сужением суставного просвета, выраженным разрушением нагружаемой поверхности с образованием костно-хрящевых дефектов, выраженным ограничением движений, постоянным чувством «хруста» при движении, начальными изменениями оси конечности.
4 стадия: тяжелая, при которой движения выраженно ограничены в суставе вплоть до полного его отсутствия (анкилоз), выраженным воспалительным процессом, его деформацией, образованием костных дефектов (в результате полного отсутствия хрящевого покрова).
Классификация артроза по локализации
Выделяют следующие виды артроза:
- пателлофеморальный артроз (поражение надколеннико-бедренного сочленения );
- артроз голеностопного сустава и суставов стопы; ; ;
- артроз челюстно-лицевого сустава;
- остеоартроз акромиально-ключичного сочленения;
- артроз локтевого сустава;
- остеоартроз кистей;
- дегенеративные изменения суставов позвоночника (вертебральный артроз).
Все перечисленные виды артроза проявляются болью и нарушением функции сустава. Специфических симптомов для каждой локализации нет.
Осложнения остеоартроза
Без лечения любое заболевание дает осложнения, и артроз не исключение. Если это первичная форма, то к основным осложнениям относятся:
- повреждения мягких структур сустава (дегенеративные разрывы менисков, разрывы связок и т. д.);
- хронический воспалительный процесс;
- анкилоз (полное отсутствие движений в суставе);
- деформация сустава.
Если это вторичная форма, то осложнения зависят от процесса, вызвавшего развитие артроза. Например, это может привести к остеопорозу, хроническому заболеванию, которое характеризуется прогрессирующим нарушением обмена веществ в костной ткани. Вследствие этого кости становятся хрупкими, нарушается их питание, в итоге остеоартроз осложняется угрозой внутрисуставных переломов. Поэтому так важно обратиться к врачу своевременно. Как писал выдающийся русский хирург Н.И.Пирогов: «Будущее принадлежит медицине профилактической».
Диагностика остеоартроза
Диагностика артроза часто начинается с врача (как правило, это травматолог-ортопед) медицинской помощи первого звена (поликлиники), где выполняется клинический осмотр и интерпретируются данные обследования (КТ, МРТ, рентгенограммы и т.п.), чтобы определить степень и тип остеоартроза. Диагностика и постановка диагноза обычно не вызывают затруднений. Если диагноз неясен или врач предполагает вторичное развитие заболевания, то для уточнения пациент направляется к врачам других специальностей (например, ревматологу). Поставить степень артроза без результатов обследования очень затруднительно. Важным для постановки диагноза и определения тактики лечения является также история заболевания, способы и попытки лечения, так как перед врачом часто стоит сложная задача дифференциальной диагностики (например, симптомы артроза и артрита часто совпадают).
Анализы и другие виды обследований
Ревмопробы, общий и биохимический анализы крови назначают для дифференциальной диагностики. Чтобы выявить артроз, достаточно КТ, МРТ и рентгенограммы.
Лечение остеоартроза
На начальных стадиях остеоартроз поддается консервативному лечению при условии комплексного подхода. Лечение требует длительного времени и преследует основную цель: либо остановить процесс разрушения на той стадии, на которой начато лечение, либо этот процесс замедлить. Комплекс включает в себя медикаментозное и немедикаментозное лечение.
Медикаментозная терапия
Для лечения артроза применятся противовоспалительная терапия (либо прием внутрь, либо местно в виде гелей или крема), хондропротективная терапия (приём препаратов на основе хондроитина сульфата и глюкозамина) и внутрисуставные инъекции (это могут быть как гомеопатические препараты, так и препараты гиалуроновой кислоты). Хондропротекторы до сих пор применяются врачами-травматологами-ортопедами на территории РФ и СНГ, их назначают курсами внутрь, однако результаты последних научных исследований западных стран опровергают положительное действие в сравнении с эффектом плацебо. [2]
Физиотерапия
При лечении артроза чаще всего применяется фонофорез и магнитотерапия.
Упражнения при артрозе
Полезна любая активность, не вызывающая боль. Особенно эффективны плавание, ЛФК, пилатес, тайчи, цигун, йога и изометрические упражнения.
Массаж при артрозе
Массаж может быть полезен, так как улучшает лимфодренаж. Однако во многих руководствах по лечению артроза такого пункта нет.
Нужно ли соблюдать диету при артрозе
Специальная диета при артрозе не требуется. Достаточно отказаться от продуктов, которые приводят к набору лишнего веса.
Наколенники при артрозе
При выборе наколенников нужно определить, какая нестабильность в суставе. Чем она больше, тем жёстче должен быть фиксатор.
Народные средства лечения артроза
Эффективность лечения артроза народными методами научно не доказана. Без адекватной терапии заболевание может привести к осложнениям: разрыву менисков и связок, хроническому воспалению, остеопорозу, деформации и полному отсутствию движений в суставе.
Хирургическое лечение артроза
При выраженных симптомах и тяжелых стадиях консервативное лечение становится неэффективным, что ставит на первое место лечение оперативное. Учитывая показания, это может быть как малоинвазивное лечение — артроскопия, так и эндопротезирование. При артроскопии (эндоскопии сустава) выполняется его санация под контролем видео-оптики, производится удаление экзостозов (при возможности) и повреждения мягких структур, что при таких стадиях наблюдается достаточно часто. Однако в последнее время пользу от такого вида вмешательства при остеоартрозе все чаще стали ставить под сомнение, так как оно не имеет должного эффекта при хронической боли, [3] а в ряде случаев и может нанести значительный вред при некачественном выполнении. [4]
Эндопротезирование – технически сложная и тяжелая операция, цель которой — создать искусственный, полностью новый сустав. Требует четких показаний и определения рисков при наличии противопоказаний. Сегодня успешно используются эндопротезы для коленного, тазобедренного и плечевого суставов. Дальнейшее амбулаторное наблюдение врачом снижает риски и сроки реабилитации, улучшает качество и эффективность выполненной операции.
Прогноз. Профилактика
Прогнозирование зависит от своевременного обращения к врачу-травматологу-ортопеду и начала комплекса лечения. В плане ликвидации морфологических изменений при остеоартрозе прогноз неблагоприятный, так как полностью восстановить хрящевую структуру сустава невозможно. В пожилом возрасте течение заболевания более тяжелое, чем в молодом. Однако при своевременном обращении к врачу и соблюдении всех рекомендаций можно добиться устранения всех жалоб и восстановить полноценную двигательную функцию сустава.
- Регулярная двигательная активность. Ошибочно мнение, что физическая активность способна «изнашивать» сустав. [7] Повышенная – да, но не регулярная и умеренная. По последним данным, любая активность, направленная на укрепление и поддержание мышечной массы, на улучшение координации, поддерживает двигательную функцию суставов и их кровоснабжение. Любая двигательная активность позволяет добиться регулярной циркуляции суставной жидкости, которая является основным источником питания для сустава и его структур. Известно, что люди, ежедневно пользующиеся общественным транспортом и имеющие пешие нагрузки, реже подвержены развитию остеоартроза.
- Контроль веса тела и адекватное его снижение. Повышенная масса увеличивает нагрузку на суставы нижних конечностей и позвоночника. Поэтому в любой протокол реабилитации и консервативного лечения остеоартроза включен курс ЛФТ (лечебной физкультуры и гимнастики).
- Коррекция и устранение врожденных деформаций. Важную роль отводят плоскостопию, с годами приводящему к нарушению оси ног, что за собой влечет повышенную непропорциональную нагрузку на отдельные участки суставов и позвоночника, деформируя их.
- Полноценное питание. Оно позволяет создать условия для полноценного обогащения сустава питательными веществами. Поэтому отказ от большого ряда продуктов, частые диеты, нерегулярное питание бедной веществами пищей (фастфуд и т.п.) может стать «пусковым механизмом» для развития остеоартроза.
- Своевременное устранение сопутствующих заболеваний. Ныне забытые диспансеризации, которые во времена СССР были обязательными, позволяли своевременно выявить и устранить заболевания еще на начальной стадии. Сопутствующие заболевания могут быть весомой причиной развития и прогрессирования артроза (например, заболевания эндокринной системы, органов ЖКТ, хронические очаги инфекций или воспаления).
Дают ли при артрозе инвалидность
Чтобы получать пенсию и социальные выплаты по инвалидности, необходимо пройти медико-социальную экспертизу (МСЭ). Инвалидность при артрозе положена, если на обследовании выявлены заметные ограничения в подвижности сустава и больной не может себя обслужить в быту.
За дополнение статьи благодарим Никиту Геращенко — травматолога, ортопеда, научного редактора портала « ПроБолезни » .
НЕСТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ ПРЕПАРАТЫ В ТЕРАПИИ ОСТЕОАРТРОЗА
Для цитирования: Каратеев Д.Е. НЕСТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ ПРЕПАРАТЫ В ТЕРАПИИ ОСТЕОАРТРОЗА. РМЖ. 1997;15:2.
В статье рассматриваются вопросы медикаментозной терапии при остеоартрозе. Представлены данные в отношении безопасности применения различных нестероидных противовоспалительных препаратов с учетом возраста больного и необходимости их длительного приема. Показана перспектива улучшения фармакокинетических параметров этих препаратов.
The paper deals with drug therapy for osteoarthrosis, gives data o n the safe use of various nonsteroidal antiinflammatory agents in terms of the patient`s age and the need for their long-term use, and shows the prospects for improving the pharmacokinetiс properties of these drugs.
Д.Е. Каратеев, канд. мед. наук, старший научный сотрудник Института ревматологии (дир. – акад. РАМН В.А. Насонова) РАМН, Москва
D.Ye. Karateyev, Candidate of Medical Sciences, Senior Researcher, Institute of Rheumatology, Russian Academy of Medical Sciences (Director V.A. Nasonova, Academician, Russian Academy of Medical Sciences), Moscow
О стеоартроз (ОА) – самое распространенное заболевание опорно-двигательного аппарата [1], имеющее важное социальное значение. Большинство больных ОА обращаются к врачу за помощью при поражениях нагрузочных суставов (коленных и тазобедренных), вызывающих боли и ограничение движений, что резко снижает качество жизни. ОА коленного сустава является основной причиной болей и функциональных нарушений в пожилом возрасте [2].
При ОА дегенерация суставного хряща, являющаяся основным признаком болезни, закономерно связана с возникновением вторичного воспаления синовиальной оболочки [1, 3]. Боль – основное клиническое проявление ОА – связана с развитием вторичного синовита, который в свою очередь усиливает процессы деградации хряща. В связи с этим в англоязычной литературе для обозначения нозологии используется термин “остеоартрит”, что подчеркивает важность воспалительного компонента при данном заболевании.
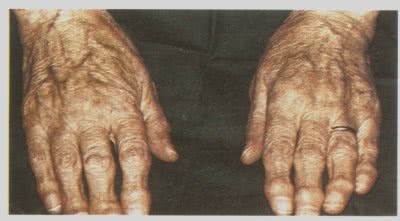
Пример остеоартроза. Узелки Гебердена (дистальные межфаланговые суставы) и Бушара (проксимальные межфаланговые суставы).
Основой лечения болевого синдрома при ОА в настоящее время являются нестероидные противовоспалительные препараты (НПВП) [4]. Трудно найти больного ОА, который не получал бы того или иного препарата этой группы хотя бы изредка. Показано, что НПВП при ОА в большинстве случаев обеспечивают более выраженный обезболивающий эффект, чем ненаркотические анальгетики, например парацетамол [5]. Мировая фармакологическая промышленность предоставляет врачам широкий выбор НПВП с различной химической структурой [6, 7]. Для НПВП характерна индивидуальная реакция на препарат, а также достаточно высокая частота побочных проявлений со стороны желудочно-кишечного тракта (ЖКТ). До сих пор открытым остается вопрос о недостатках и преимуществах той или иной группы НПВП.

Пример остеоартроза. Узелки Гебердена (дистальные межфаланговые суставы) и Бушара (проксимальные межфаланговые суставы).
В России, как и во всем мире, для лечения ОА наиболее часто применяются НПВП, представленные в таблице.
При выборе НПВП для лечения больного ОА врач должен учесть следующие важные моменты:
1. Влияние НПВП на ЖКТ
2. Влияние НПВП на суставной хрящ
3. Возрастные особенности больных ОА
4. Необходимость и возможность длительного приема НПВП
5. Возможности улучшения эффективности и переносимости НПВП
Таблица. НПВП, наиболее часто применяющиеся для лечения ОА
| Группа | Препарат | Средние дозы, мг/сут |
| Производные арилпропионовой кислоты | Ибупрофен (бруфен, мотрин) | 800 – 1600 |
| Флюрбипрофен(флугалин) | 200 | |
| Напроксен(напросин) | 500 – 1000 | |
| Кетопрофен(кетонал) | 150 – 300 | |
| Тиапрофеновая кислота (сургам) | 600 | |
| Производные арилуксусной кислоты | Диклофенак(вольтарен, диклонат, диклак, ортофен диклоран) | 100 – 150 |
| Оксикамы | Пироксикам (фельден) | 20 – 40 |
| Производные индолуксусной кислоты | Индометацин (метиндол) | 100 – 150 |
Влияние на ЖКТ
В настоящее время можно считать доказанным, что прием больших доз НПВП (например, при ревматоидном артрите) часто вызывает эрозивно-язвенное поражение ЖКТ, в первую очередь слизистой желудка (по данным Муравьева Ю. В. и соавт., до 40% от общего числа больных, которым проводилась гастроскопия). Эрозивно-язвенное поражение слизистой ЖКТ является характерным последствием применения НПВП, непосредственно связанным с механизмом их действия – ингибированием циклооксигеназы-1 [8].
В отношении сравнительной безопасности различных НПВП во всем мире проведено большое количество клиничеcких испытаний, и эти исследования нельзя считать завершенными. Однако, суммируя данные различных клинических испытаний, уже сейчас можно получить довольно определенную картину. Согласно данным Комитета по безопасности лекарств Великобритании и ряда других исследований [9], в порядке нарастания относительного риска развития неблагоприятных реакций со стороны ЖКТ наиболее распространенными в нашей стране НПВП являются: 1) ибупрофен; 2) диклофенак; 3) флюрбипрофен; 4) напроксен; 5) кетопрофен; 6) пироксикам; 7) индометацин.
Таким образом, наиболее хорошо переносится ибупрофен, а наиболее часто поражение пищеварительного тракта встречается при лечении индометацином.
Схема: патологические изменения в суставе при остеоартрите
Деградация хряща
Серьезным доводом против длительного применения НПВП у больных ОА является представление о вероятном отрицательном воздействии этих препаратов на хрящ. Следует обратить особое внимание на то, что, купируя болевой синдром и явления синовита, НПВП не задерживают дегенеративно-дистрофических изменений в хряще и кости. Есть целый ряд сообщений о том, что длительный прием НПВП может способствовать прогрессированию деградации хряща [1].
В то же время только на фоне применения индометацина усиление деградации хряща и прогрессирование патологического процесса в суставах можно считать доказанным [10 – 12]. В основном это касается ОА тазобедренного сустава. Наличие отрицательного действия НПВП в отношении прогрессирования ОА для других НПВП весьма дискутабельно. Специальные исследования показали, что тиапрофеновая кислота в отличие от индометацина не вызывает ухудшения рентгенологической картины при гонартрозе даже при многолетнем применении [35]. По всей видимости, не оказывают отрицательного действия на хрящ и производные арилпропионовой кислоты (ибупрофен и др.).
Учет возрастных особенностей больных ОА
Вопрос о переносимости НПВП особенно важен, если учесть, что ОА заболевают, как правило, в пожилом возрасте, когда фармакокинетика различных лекарственных препаратов может меняться, в первую очередь за счет изменения функции печени и почек. Так, показано, что ряд препаратов, таких как индометацин, дифлунисал, напроксен и кетопрофен, могут кумулировать с повышением вероятности токсических реакций у пожилых пациентов, это связывают с возрастным снижением функции почек [13].
С другой стороны, не все препараты пожилые пациенты переносят хуже. Есть данные, что фармакокинетика ибупрофена не меняется в пожилом возрасте на фоне возрастных изменений функций печени в отличие от ряда других препаратов, например сулиндака [14]. В литературе имеются данные о лучшей переносимости флюрбипрофена (флугалина), в частности в отношении влияния на функцию почек, по сравнению с пироксикамом у больных ревматоидным артритом в возрасте старше 60 лет [15].
Необходимость и возможность длительного приема НПВП
Существует довольно распространенное мнение о том, что НПВП необходимо назначать только короткими курсами, максимум на несколько недель, для снятия болевого синдрома. В то же время характерной особенностью ОА является прогрессирующая дегенерация хряща у лиц пожилого и старческого возраста, клинически проявляющаяся болями, скованностью и ограничением движений в пораженных суставах, и по мере прогрессирования явления синовита и соответственно болевой синдром становятся все более стойкими.
В Институте ревматологии РАМН проведено клиническое исследование (являющееся частью обширной многоцентровой апробации), посвященное изучению эффективности и переносимости флюрбипрофена (флугалин) при непрерывном длительном (12 мес) приеме у больных ОА [16 – 18]. Это исследование позволило сделать вывод о том, что флугалин является достаточно эффективным средством для купирования болевого синдрома при ОА, обладающим удовлетворительной переносимостью.
Судя по динамике болевого синдрома у наших пациентов, у большинства больных можно достигнуть стабильного снижения уровня болевых ощущений в суставах при относительно длительном (3 – 6 мес) приеме препарата, особенно в случаях наличия отчетливо клинически определяемого вторичного синовита. При этом суждение об эффективности и переносимости флугалина врач может составить за более короткий (1 – 3 мес) период наблюдения.
При условии отсутствия побочных проявлений в первые 3 – 4 мес более продолжительный (6 – 12 мес) прием препарата не сопровождался, очевидно, существенным повышением риска развития осложнений со стороны ЖКТ.
Возможности улучшения эффективности и переносимости НПВП
Пролонгированные формы НПВП
Одним из способов улучшить фармакокинетические параметры НПВП является применение пролонгированных форм (ретард). Это позволяет более длительно поддерживать достаточно высокий уровень препарата в крови, сократить число приемов препарата в день и добиться некоторого улучшения переносимости со стороны ЖКТ. Наиболее хорошо зарекомендовали себя пролонгированные формы диклофенака (вольтарен-ретард), ибупрофена (бруфен-ретард) и флюрбипрофена (флугалин-ретард).
Ибупрофен показал более высокую эффективность и лучшую переносимость пролонгированной формы по сравнению с обычной таблетированной формой препарата при ОА и ревматоидном артрите [19, 20]. Наши исследования [16 – 18] продемонстрировали, что пролонгированная форма флюрбипрофена (флугалин-ретард) дает несколько более выраженный обезболивающий эффект при ОА, чем короткоживущая форма препарата (что, очевидно, обусловлено более плавным снижением концентрации препарата в крови после однократного приема). Кроме того, имелась отчетливая тенденция к лучшей переносимости пролонгированной формы со стороны ЖКТ. Для больных применение флугалина-ретард было существенно более удобным, поскольку позволяло принимать лекарство 1 раз в день.
Комбинации с гастропротекторами
В настоящее время делаются попытки уменьшить риск развития гастропатий при лечении НПВП путем комбинации их с так называемыми гастропротекторами – средствами, применяемыми для лечения язвенной болезни желудка и двенадцатиперстной кишки, обладающими профилактическим эффектом. Наиболее известен препарат артротек – комбинация диклофенака или мизопростола (сайтотек), который близок по структуре к естественному простагландину Е1, стимулирующему слизеобразование и подавляющему секрецию желудочного сока. Имеется ряд обнадеживающих сообщений об уменьшении частоты эрозивно-язвенного поражения ЖКТ при лечении артротеком, однако это нельзя считать установленным фактом. Есть данные о том, что при ОА артротек достоверно не отличается от диклофенака ни по эффективности, ни по переносимости [21]. Поэтому целесообразность комбинации диклофенак + мизопростол еще требует подтверждения.
Ингибирование циклооксигеназы-2
Другим перспективным направлением по улучшению переносимости НПВП является разработка лекарств, селективно ингибирующих циклооксигеназу-2. Согласно современным представлениям, НПВП обладают рядом фармакологических эффектов. Основным, очевидно, является, как было показано J. Vane в 1971 г., ингибирование простагландинсинтетазы (циклооксигеназы) – фермента, катализирующего превращение арахидоновой кислоты в простагландины, являющиеся медиаторами воспаления. У большинства препаратов из группы НПВП этот механизм также приводит к ингибированию синтеза “полезных” простагландинов, регулирующих уровень кислотности желудочного сока, функционирование слизистого барьера желудка, обладающих вазодилататорным эффектом, что приводит к возможности возникновения нежелательных реакций.
Сейчас известно, что существуют 2 изоформы циклооксигеназы (ЦОГ) – циклооксигеназа-1 (ЦОГ-1) и циклооксигеназа-2 (ЦОГ-2). ЦОГ-1 – конституциональный, “полезный”фермент, синтезирующий тромбоксан А2, простагландин Е2, простациклин, участвующие в важнейших физиологических процессах. ЦОГ-2 – “индуцируемый” фермент, который катализирует синтез простагландинов, участвующих в воспалительном процессе [22]. Очевидно, что для получения противовоспалительного эффекта желательно иметь препарат, ингибирующий синтез “патологической” ЦОГ-2 и не вляющий на “физиологическую” ЦОГ-1. Все широко применяемые НПВП ингибируют как ЦОГ-2, так и ЦОГ-1.
В последние годы синтезированы такие препараты, как мелоксикам и нимесулид, которые способны ингибировать ЦОГ-2 существенно более выраженно, чем ЦОГ-1 [23, 24]. Рядом авторов показано, что эти препараты, вероятно, могут лучше переноситься больными, чем традиционные НПВП, причем эти сведения выглядят более достоверными в отношении мелоксикама. Если рузультаты предварительных исследований будут подтверждены клинической практикой, врачи и больные смогут получить безопасный обезболивающий и противовоспалительный препарат. Однако клинические данные об эффективности и безопасности, похоже, прямо не коррелируют со степенью селективности ингибирования ЦОГ-2. Таким образом, вопрос о преимуществах мелоксикама и нимесулида перед другими НПВП остается открытым.
Итак, основываясь на приведенных выше данных, идеальный НПВП для лечения ОА должны отличать следующие свойства: 1) хороший обезболивающий эффект; 2) низкая частота поражения ЖКТ; 3) отсутствие отрицательного действия на хрящ; 4) удобная лекарственная форма.
По-видимому, в настоящее время этим требованиям наиболее точно отвечают производные арилпропионовой кислоты. Препараты этой группы, в первую очередь ибупрофен, считаются классическими для лечения ОА, поскольку они отличаются хорошим обезболивающим эффектом и удовлетворительной переносимостью.
Ибупрофен (бруфен) является стандартом хорошей переносимости НПВП, что нашло отражение в том факте, что в большинстве стран разрешена безрецептурная продажа этого препарата [25]. Согласно данным ряда исследований [26], применение ибупрофена ассоциировано с наименьшим риском развития язвенного поражения ЖКТ по сравнению со всеми другими препаратами группы НПВП.
Во всем мире ибупрофен широко применяется для лечения больных ОА, поскольку отличается хорошим обезболивающим эффектом и вполне удовлетворительной переносимостью. При этом он оказывает менее выраженное противовоспалительное действие, хотя в ряде случаев и применяется для лечения воспалительных заболеваний суставов, таких как ревматоидный артрит. По сравнению с ибупрофеном флюрбипрофен (флугалин) – препарат следующего поколения, который обладает более мощным противовоспалительным эффектом, что позволяет применять его в меньших дозах. Оба препарата применются для лечения ОА уже несколько десятилетий. За это время проведены многочисленные клинические испытания, продемонстрировавшие достаточно высокую клиническую эффективность, а также вполне удовлетворительную их переносимость. По переносимости как ибупрофен, так и флюрбипрофен в целом ряде исследований превосходили такие препараты, как индометацин, диклофенак, напроксен и ацетилсалициловая кислота [27 – 30]. Наши исследования [16 – 18] показали возможность и относительную безопасность длительного (многомесячного) приема поддерживающей дозы флюрбипрофена. При этом как ибупрофен, так и флюрбипрофен выпускаются в виде широкого спектра лекарственных форм, в том числе и пролонгированных, обеспечивающих хороший клинический эффект при приеме 1 раз в сутки.
При необходимости получения более выраженного противовоспалительного эффекта (при упорном вторичном синовите, периартрите) целесообразно применение диклофенака (вольтарен, диклонат, наклофен), обладающего выраженной противовоспалительной активностью, который также отличается хорошей переносимостью и многообразием лекарственных форм – от быстродействующих до пролонгированных.
В то же время следует отметить, что для НПВП характерна индивидуальная реакция больного на препарат, в связи с чем и другие препараты из этой группы могут быть чрезвычайно полезны ряду пациентов.
1. Агабабова Э. Р. // Клин. ревматология, 1995, №4, с. 3 – 6.
2. Cushnaghan J, et al. // British Med J 1994;308:753–5.
3. Pelletier J-P, Martel-Pelletier J. Rheumatology in Europe 1995;24(2):59–60.
4. Bellamy N and Bradley L. Arthritis and Rheumatism 1996;39:357–62.
5. Rickavance L, et al. Rheumatology in Europe 1995;24(3):330.
6. Денисов Л. Н. // Materia Medica 1995;1:56–67.
7. Насонов Е. Л. Противовоспалитльная терапия ревматических болезней. М.: “М-Сити”, 1996,345 с.
8. Spangler R. Arthritis and Rheumatism 1996;26:435–46.
9. Донован С. Клин. ревматология 1995;2:47–50.
10. Newman N, Ling R. Lan cet 1985;i:11–4.
11. Rashad S, et al. Lancet 1989;2:111–3.
12. Gishen P, et al. Rheumatology in Europe 1995;24:(3):331.
13. Johnson A, et al. Med J Aust 1995;163:155–8.
14. Astbury C, Bird H. J Drugs Dev 1993;6(2):57–61.
15. Hrba J, et al. Rheumatology in Europe 1995;24(3):217.
16. Каратеев Д. Е. и соавт. // III Российский нац. конгресс “Человек и лекарство”, 1996, Тезисы докладов, с. 130.
17. Насонова В. А. и соавт. // Клин. ревматология,1996, №1, с.25–9.
18. Karateyev D, et al. Rhe u matology in Europe 1996;1:355.
19. Delbridhe A, Dumelow N, Donovan S. Rheumatology in Europe 1995;24(3):326.
20. Donovan S, Dumelow N, Delbridge A. Rheumatology in Europe 1995;24(3):326.
21. Насонова В. А. и соавт. // Клин. ревматология, 1995, №5 , с. 35–7.
22. Vane JR. British J Rheumatol 1996;35(1);1–3.
23. Engelhardt G. British J Rheumatol 1996;35(1):4–12.
24. Davis R, Brogden R. Drugs 1994;48:431–54.
25. Рики Р. // Клин. ревматология, 1995, №2, с. 57–60.
26. Griffin M, et al. Ann Int Med 1991;114:257–63.
27. Саундерс С. А., Хиггинс К. М., Донован С. // Клин. ревматология, 1995, №2, с. 50–6.
28. Frank O. Current Medical Research and Opinion 1977;5:91–8.
29. Kogstag O. XIIIth Int Cong Rheumatol 1973. Kyoto Japan.
30. Ren es J, Donovan S, Higgins C, Saunders C. Rheumatology in Europe 1995;24(3):222.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Лечение артроза тазобедренного сустава
Артроз тазобедренного сустава – это наиболее распространенный вид артрозов. Поскольку тазобедренный сустав (ТБС) превосходит по размеру все другие и имеет многовекторную ось вращения, он испытывает колоссальную нагрузку в течение жизни человека – при ходьбе, беге, прыжках, подъеме на лестницу, занятиях спортом и повседневными делами.
Часто пациентам приходится озаботиться симптомами и лечением артроза тазобедренного сустава уже в возрасте 25-35 лет. Болезнь может стремительно прогрессировать под влиянием травмы, декомпенсированной физической нагрузки (несоблюдение техники выполнения спортивных упражнений, “стоячая” работа, лишний вес), наследственных факторов, инфекционных и хронических болезней.
Эффективное лечение остеоартроза тазобедренного сустава, однако, может сохранить подвижность и предотвратить разрушение костей. В пожилом возрасте оно помогает избежать еще более опасных патологий – таких, как некроз или перелом головки бедренной кости.
Симптомы артроза тазобедренного сустава
Симптомы и лечение артроза тазобедренного сустава зависят от стадии заболевания.
- 1 стадия. Пациенты ощущают несильную боль в области паха, которая возникает после физической нагрузки, длительного стояния или резких движений в сочленении, а затем полностью исчезает в состоянии покоя.
- 2 стадия. Болевой синдром усиливается и беспокоит пациента даже при обычных бытовых нагрузках. Боли могут отдавать в поясницу или внутреннюю поверхность бедра. Появляется скованность, хруст, сокращается амплитуда движений в суставе. Мышечно-связочный аппарат начинает слабеть, из-за чего наблюдается повышенная утомляемость.
- 3 стадия. Боль ощущается постоянно, без трости или ходунков пациентам сложно передвигаться. Движения в суставе сильно ограничены. Подъем по лестнице представляет серьезную трудность. Наблюдаются нарушения походки (хромота, припадание на одну или обе ноги). При одностороннем коксартрозе невооруженным глазом заметен перекос таза и искривление позвоночника.
- 4 стадия. Суставная щель смыкается из-за разрастания остеофитов и любое движение в суставе практически невозможно. Он утрачивает свои функции и сильно деформируется из-за разрушения кости.
Прогнозы при артрозе тазобедренного сустава
При успешном пожизненном лечении боли при артрозе тазобедренного сустава могут полностью отсутствовать или редко беспокоить пациента. Перспективы этой терапии зависят от соблюдения больным правил ревматолога и его личной самодисциплины. Обращаем ваше внимание на то, что наиболее точный прогноз по заболеванию может составить только лечащий врач.
При своевременном и регулярном лечении
Если прогрессированию болезни не способствуют хронические заболевания и лечение артроза тазобедренного сустава началось на 1 или 2 стадии, можно избежать протезирования ТБС. Инвалидность и потеря трудоспособности при соблюдении рекомендаций врача сдвигается на 20 лет, а иногда пациент сохраняет практически неограниченный объем движений в суставе до глубокой старости. Наилучший прогноз возможен при т.н. доброкачественном артрозе – когда износ хряща зависит от внешних факторов (профессиональная деятельность, санитарные нарушения). В этом случае стоит исключить их и пройти курс восстановительной терапии, чтобы затормозить дальнейшую дегенерацию сустава.
Своевременное хирургическое лечение остеоартроза тазобедренного сустава 3 степени поможет избежать неподвижности сустава, последствий для всего опорно-двигательного аппарата и долгих лет боли. При отсутствии противопоказаний протезирование поможет вернуться к былой активности.
При самолечении
При выборе метода лечения артроза тазобедренного сустава врач учитывает возраст, конституцию, физическую форму больного, состояние его здоровья, специфические симптомы заболевания и его стадию. При этом исследуется сужение просвета суставной щели, наличие остеофитов, скорость прогрессирования артроза, качество синовиальной жидкости и другие показатели.
Самостоятельное лечение остеоартроза тазобедренного сустава народными методами не учитывает эти индивидуальные показатели и вместо желаемого результата может привести к тяжелому обострению, нарушению обмена веществ и усугублению стадии болезни. Но самое худшее – это время, потраченное на иллюзию, что такое тяжелое хроническое заболевание, как артроз ТБС, можно вылечить только народными методами. Избегайте приема противовоспалительных препаратов без назначения врача – это может повлечь серьезные проблемы с пищеварительной и эндокринной системой!
Без лечения
Оставленный без лечения артроз тазобедренного сустава прогрессирует в среднем в 2-4 раза быстрее. Ухудшение качества жизни и наступление инвалидности в этом случае возможно уже в сравнительно молодом возрасте – около 45-50 лет. У больных ухудшается сон, снижается физическая активность, наблюдаются расстройства в психоэмоциональной сфере. Боль мешает им подниматься с кровати утром, гулять с внуками, ходить на работу.
Лечение остеоартроза тазобедренного сустава
Приоритетным направлением лечения при артрозе тазобедренного сустава 1 степени считается амбулаторная консервативная терапия. В нее входит медикаментозное лечение артроза тазобедренного сустава, физиотерапия, диетотерапия, ношение бандажей и регулируемых ортезов. Такой подход позволяет снять боль, сохранить функцию мышц и увеличить подвижность в суставе. Лечение артроза тазобедренного сустава 2 степени проводится аналогично.
Если консервативное лечение артроза тазобедренного сустава запоздало или неэффективно, дегенерация хряща быстро прогрессирует, проводится операция. Изредка врач может принять решение об остеотомии или артродезе, но в большинстве случаев при лечении артроза тазобедренного сустава 3 степени назначается эндопротезирование – частичная или полная замена больного сустава. Протез, изготовленный из металла и керамического или полимерного вкладыша, служит от 15 до 25 лет, после чего требуется его замена. Тотальная артропластика (полная замена сустава) – это самое эффективное лечение артроза тазобедренного сустава. Она позволяет полностью восстановить его функциональность при минимальном разрезе до 8 см длиной и возможностью ходить с опорой уже через день. Полная реабилитация длится 1-3 месяца.
Физиотерапевтические методы лечения артроза тазобедренного сустава
Физиотерапия при артрозе ТБС проводится курсами, по показаниям врача. Практически все методики, кроме магнитной и криотерапии, разрешены только в период ремиссии, при полном отсутствии воспалительной симптоматики. Для лечения остеоартроза тазобедренного сустава используют следующие меры:
- ультравысокочастотная терапия;
- ультразвуковая терапия;
- лазерная терапия;
- магнитотерапия;
- лечебная гимнастика (ЛФК);
- лечебный массаж и мануальная терапия;
- озонотерапия;
- криотерапия;
- аккупунктура;
- тракционная терапия (вытяжение);
- парафиновые аппликации и обертывания;
- бальнеотерапия и грязелечение;
- гидромассаж.
Лечение артроза тазобедренного сустава при помощи ЛФК
Лечебная физкультура при артрозе ТБС направлена на укрепление мышц и связок – они являются природным ортезом, который сокращает нагрузку на сустав и поддерживает его в физиологически правильном положении. Как следствие, лечение остеоартроза тазобедренного сустава гимнастикой помогает снять боль и воспаление, улучшает подвижность, замедляет износ хряща и обеспечивает поступление питательных веществ в синовиальную жидкость. Укрепить ноги помогут следующие упражнения:
- Исходное положение – сидя на полу, упор на вытянутые руки сзади. Ноги прямые перед собой. Сгибаем и разгибаем пальцы на ногах.
- Исходное положение – то же. Попеременно сгибаем и разгибаем стопы (носок на себя, носок от себя).
- Исходное положение – то же. Сгибаем ногу в колене, подтягивая ее к себе по коврику или на весу. Желательно касаться пола только носком по завершении движения.
- Исходное положение – лежа на спине, ноги согнуты в коленях, стопы стоят на полу. Делаем упражнение “лягушка” – разводим согнутые колени и удерживаем их 20 секунд. Затем снова сводим.
- Исходное положение – лежа на спине, одна нога прямая, другая согнута и отведена в сторону. Лежим так одну минуту, затем меняем ноги.
- Исходное положение – лежа на спине, ноги прямые, лежат свободно. Сводим носки вовнутрь, соприкасаясь ими, а затем разводим в стороны. Повторяем в темпе 10 раз.
- Исходное положение – лежа на спине, одна нога (со стороны пораженного сустава) закинута на другую. Двигаем стопой нижней ноги как в упражнении выше.
- Исходное положение – лежа на спине. Подтягиваем колено к животу, придерживая заднюю поверхность бедра сцепленными в замок пальцами. Выполнять 30 секунд на каждую ногу.
- Исходное положение – то же. Подтягиваем согнутые в коленях ноги к животу и удерживаем их под коленями сцепленными в замок пальцами. Выполнять не менее 30 секунд.
- Исходное положение – то же. Выпрямленную ногу отводим в сторону над полом. 20-30 раз на каждую ногу.
- Исходное положение – стоя. Поставьте стул сбоку, спинкой к вам. Придерживаясь за спинку стула и стоя на одной ноге, раскачивайте вторую взад-вперед, как маятник. 20-30 раз.
Массаж в лечении остеоартроза тазобедренного сустава
Массаж – эффективная релаксационная и восстанавливающая методика для лечения артроза тазобедренного сустава на ранних стадиях. В качестве лечения артроза тазобедренного сустава 1 степени (а также 2-й – при отсутствии болей и отека) он способен продлить ремиссию, снять дискомфорт и болевые ощущения без лекарств, улучшить трофику тканей и замедлить дегенерацию хряща. Также он устраняет спазмы, которые мешают сну и передвижению, укрепляет связки, нормализует походку, позволяет быстро размяться при смене отдыха на активную деятельность и наоборот.
При артрозе ТБС желателен профессиональный лечебный массаж (как минимум, 10-12 сеансов). Но бережный самомассаж на дому тоже помогает улучшить состояние. При этом важно избегать болей и сильного дискомфорта. При малейших признаках воспаления в суставе манипуляции временно прекращаются – возобновлять их можно с разрешения лечащего врача, после курса противовоспалительной терапии.
Даже в тех случаях, когда пациент страдает от одностороннего коксартроза, массаж проводится на обе стороны. Как же делать его правильно?
- Для начала примите удобную позу, которая позволит вам разгрузить бедра и поясницу. Например, лежа на спине, боку или на животе.
- Начните мягко массировать область вокруг пораженного сустава. Если у вас есть помощник, попросите его поглаживать спину в течение 7-10 минут от лопаток до крестца, чтобы улучшить циркуляцию крови.
- Переходите к медленному поглаживанию поясницы, а затем – круговой разминке крестцово-поясничного отдела двумя пальцами.
- Промассируйте позвоночник большими пальцами, насколько это позволяет поза, постепенно спуская на поясницу.
- Вдавите ладони в крестцово-ягодичную зону и приступайте к растиранию и растягиванию мышц. На этом подготовка окончена.
- Разотрите бедра ладонями, а затем хорошо промассируйте их по кругу большими пальцами.
- Разомните внутреннюю поверхность бедра без надавливания (чтобы не пережать сосуды). Лучше захватите между большим и другими пальцами жировую складку и тщательно разомните ее.
- Важно! Завершите процедуру расслабляющими поглаживаниями и похлопываниями.
В массаже бедра используются поперечные, продольные, обхватывающие, выжимающие движения. Растирание выполняют различными частями ладони или согнутыми пальцами по направлению к паховой зоне.
После хирургического лечения остеоартроза тазобедренного сустава 3 степени и снятия швов массаж используется для реабилитации и восстановления двигательных функций.
Лечение артроза тазобедренного сустава диетой
Главный принцип питания при лечении артроза тазобедренного сустава – это его разнообразность и сбалансированность по основным показателями (витамины, минералы, белки, в т.ч. незаменимые аминокислоты). Важно употреблять продукты с высоким содержанием кальция, серы, цинка, магния и селена. Из витаминов первоочередное значение имеют витамины А и группы В (дают противовоспалительный эффект), С, D, Е. Низкобелковые диеты при лечении остеоартроза тазобедренного сустава противопоказаны. Поэтому в обязательном порядке включите в меню:
- Диетическое мясо, птицу, рыбу.
- Яйца.
- Молоко и молочные продукты.
- Фрукты, овощи и свежую зелень.
- Цельнозерновые продукты и семена масличных растений (например, льна), а также орехи.
- Блюда и продукты с естественными хондропротекторами (холодцы, желе, хрящи, свиные ноги, уши и прочее).
А вот потребление углеводов лучше сократить – ведь даже небольшой избыточный вес создает колоссальную нагрузку на больной сустав. Не зря реабилитологи шутят, что сбросить пару кило – это самое эффективное лечение артроза тазобедренного сустава. Также нужно исключить соленые, острые, сладкие и жареные блюда, из-за которых организм задерживает воду. Сведите к минимуму потребление:
- фастфуда и полуфабрикатов;
- выпечки, конфет и кондитерских изделий;
- колбас и маринадов.
Не забывайте выпивать минимум 2,5 литров воды в день!
Медикаментозное лечение артроза тазобедренного сустава
Лечение остеоартроза тазобедренного сустава препаратами проводится сугубо по назначению врача. При обострении и сильных болях допускается прием обычных анальгетиков или щадящих противовоспалительных (ибупрофен) средств, однако не более 10 дней до обращения к специалисту. В противном случае картина заболевания будет размыта и врачу будет трудно подобрать адекватное лечение при артрозе тазобедренного сустава.
Существует несколько лекарственных групп препаратов для лечения артроза тазобедренного сустава. В комплексном лечении артроза тазобедренного сустава препаратами используется 5 основных фармацевтических групп.
Противовоспалительные препараты в лечении остеоартроза тазобедренного сустава
Отек, застой крови и других жидкостей, локальное повышение температуры и боль – эти распространенные симптомы воспаления при артрозе не только отравляют жизнь пациента, но и усугубляют течение болезни. Со временем они приводят к голоданию тканей, обеднению синовиальной жидкости, которая “кормит” хрящ и нарушению ее вязкости (из-за чего трение разрушает поверхность суставной оболочки!), мышечной дистрофии и стойкому ухудшению подвижности.
Но главная опасность воспаления заключается в гибели хрящевых клеток – хондроцитов. Распадаясь в больших количествах, они создают скопление ферментов, которые “разъедают” поверхность суставного хряща.
Поэтому для снятия воспалительных симптомов и восстановления метаболизма тканей используется 2 группы противовоспалительных средств: нестероидные (НПВС, НПВП) и глюкокортикостероидные.
НПВС считаются более щадящими, хоть и они и могут повлиять на пищеварительную систему. Поэтому их назначают в первую очередь. При лечении артроза тазобедренного сустава 2 степени – курсами или по необходимости.
К ним относятся: Артрадол, Нимесулид, Ибупрофен, Мелоксикам, Кетопрофен, Ксефокам, Индометацин, Диклофенак.
Если НПВС не справляются, ревматологи назначают “тяжелую артиллерию” – кортикостероидные препараты. Они экстренно снимают даже сильную боль и воспаление, но принимать их долго и в больших дозировках нельзя. Как и любые гормональные препараты, они могут повлиять на вес и состояние внутренних органов, а при превышении терапевтической дозы – усугубить течение артроза.
Препаратами выбора при лечении артроза тазобедренного сустава 3 степени являются: Гидрокортизон, Дипроспан, Преднизолон, Метилпреднизолон.
Хондропротекторы при остеоартрозе тазобедренного сустава
Хотя противовоспалительные препараты снимают симптомы, они не решают проблему – не восстанавливают разрушенную поверхность хряща и не обогащают синовиальную жидкость гликозаминогликанами. Поэтому эффективное лечение артроза тазобедренного сустава немыслимо без препаратов хондроитин и глюкозамин сульфата, которые поставляют в организм строительный материал для образования новых хрящевых клеток.
Поскольку обмен веществ в хрящевой ткани очень медленный, хондропротекторы нужно принимать долго – по 3-6 месяцев ежегодно. Зато, при пожизненном профилактическом приеме, они помогают выйти на безмедикаментозную ремиссию.
К числу хондропротекторов относятся: Артракам, Эльбона, Терафлекс, Мовекс, Протекон, Дона, Хондроитин Комплекс, Алфлутоп.
Ангиопротекторы и корректоры микроциркуляции
Воспаление и микротравмы, которые сопутствуют артрозу, нарушают кровоснабжение вокруг пораженного сустава. Но именно капилляры приносят питательные вещества к границам суставной сумки.
Снять отек и улучшить трофику тканей помогают: Троксевазин, Троксерутин, экстракт конского каштана, Детралекс, Актовегин, Пентоксифиллин.
Миорелаксанты
Когда опорная функция сустава нарушаются, организм пытается компенсировать ее за счет мышц и связок, которые не предназначены для такой почти беспрерывной нагрузки. Из-за хронического перенапряжения в мышцах появляются боль и спазмы. Эти судороги могут мешать сну или ходьбе.
Чтобы устранить их, при лечении остеоартроза тазобедренного сустава назначают: Мидокалм, Баклофен, Сирдалуд, Толперизон.
Наружные и разогревающие средства
Препараты этой группы обладают сосудорасширяющим эффектом. Они помогают снять отек, уменьшить боль и психологически отвлечься от дискомфорта в суставе.
Обычно для лечения артроза тазобедренного сустава применяют средства на основе животных ядов или жгучих растительных экстрактов: Випросал, Апизартрон, Кобратоксин, Живокост, Эспол, мазь Капсаициновая.
Форма выпуска препаратов для лечения артроза тазобедренного сустава
В зависимости от клинических проявлений артроза и образа жизни пациента, врач-ревматолог назначает препараты для лечения остеоартроза тазобедренного сустава в различных формах.
Таблетки, капсулы, порошки
Эти средства для лечения артроза тазобедренного сустава легко дозировать и брать с собой. Для приема нужен всего лишь стакан с водой. Также блистер или упаковка позволяет отслеживать, сколько дней уже длится курс. Такие препараты отличаются хорошей биодоступностью (90% для таблеток и 95% для саше, таких как Артракам). Но противовоспалительные в таблетках могут оказывать негативное воздействие на слизистые желудка и кишечника – при гастрите, язве, колите для лечения остеоартроза тазобедренного сустава лучше предпочесть инъекции.
Инъекции для внутримышечного и внутрисуставного введения
В виде инъекций обычно вводят противовоспалительные средства, миорелаксанты и хондропротекторы. Это гарантирует максимальную биодоступность, щадит слизистую желудка, но обычно требует присутствия медицинского работника. Делать внутрисуставные инъекции без специальной квалификации строго запрещено!
Мази, гели и кремы
Наружные средства для лечения артроза тазобедренного сустава обладают невысокой биодоступностью (около 5%), что ограничивает их применение в терапии вспомогательной ролью. Зато противопоказаний к их использованию гораздо меньше.
Реже встречаются жидкие препараты для лечения артроза тазобедренного сустава – в виде бальзамов, растворов для компрессов.
Перспективы противовоспалительной терапии остеоартроза
Деформирующий остеоартроз (ОА) — одно из самых распространенных заболеваний человека, известное еще в глубокой древности. Признаки О.А. найдены в останках первобытных людей, египетских фараонов. ХХ век ознаменовался множеством технических новшеств, которые во многом изменили быт людей. С одной стороны, облегчение физического труда уменьшило нагрузки на суставы человека, с другой стороны, именно появление многих технических приспособлений привело к увеличению развития артроза у людей определенных профессий: бурильщиков, шахтеров, работников на виброустановках и т. д. Развитие транспортных средств привело к снижению двигательной активности значительной части населения, возрастание материального благополучия — к увеличению массы тела выше нормы более чем у половины населения земного шара. В настоящий момент распространенность ОА неуклонно возрастает, как и доля лиц преклонного возраста [37].
В 1986 г. подкомитет по остеоартрозу Комитета по диагностическим и терапевтическим критериям American College of Rheumatology (ACR) предложил следующее определение OA: «Остеоартроз — это гетерогенная группа болезней, которые ведут к появлению симптомов со стороны суставов, обусловленных нарушением целости суставного хряща, а также изменениями подлежащей кости» [13].
В 2003 г. В.А. Насонова в книге «Рациональная фармакотерапия ревматических заболеваний» дала более полное определение данному заболеванию. ОА — гетерогенная группа заболеваний различной этиологии, но со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы и околосуставных мышц [23].
Высокие функциональные требования, предъявляемые к коленному суставу, уникальность анатомического строения и биомеханики — все эти факторы обусловливают высокую частоту его поражения в течение всей жизни человека [19].
Эпидемиология остеоартроза
Из всех заболеваний опорно-двигательной системы ОА (по международной классификации — остеоартрит) (М15—М19 по МКБ-10) представляет наиболее сложную социально-экономическую и медицинскую проблему [30]. По официальной статистике России, в 2004 г. общее количество зарегистрированных больных с поражением костно-мышечной системы составило более 14 млн человек [8].
По данным Международной декады, посвященной костно-суставным нарушениям, в США артритами страдают более 42 млн человек, а более чем у 7 млн человек ограничена подвижность. Инвалидность вследствие артрита сопровождается большим экономическим ущербом для самих больных, их семей и общества. В США ежегодно 39 млн больных артритами обращаются к врачу за помощью, более 500 тыс. из них госпитализируются. При этом затраты на медицинскую помощь составили 15 млрд долларов, а общие экономические потери — 65 млрд. Прогностические статистические данные показывают, что если не вмешиваться в ситуацию, то к 2020 г. артритами могут заболеть 60 млн человек, т. е. почти 20% популяции, и 11 млн из них могут стать инвалидами. Имеют ли болезни опорно-двигательной системы значение для российского общества и российского здравоохранения? Безусловно, общая распространенность заболеваний опорно-двигательного аппарата за 10 лет (1988—1997 гг.) выросла с 7,5 млн до 11,2 млн, увеличившись более чем на 49% [21, 22].
По данным многочисленных авторов (Н.И. Коршунов, В.В. Марасаева, Э.Я. Баранова, Е.С. Цветкова, Э.Р. Агабабова, Н.А. Богомолова, Р.М. Тихилова, 2006; K. Blanc, 2004; E. Roos, 2007), социально-экономическая значимость проблемы определяется преимущественным (до 60—82,5%), поражением лиц среднего, наиболее трудоспособного возраста и высоким удельным весом (до 35%) пациентов, получивших инвалидность по поводу данного заболевания. Социально-экономическую значимость проблеме придает факт широкого распространения патологии у пациентов среднего возраста среди всего населения [15].
Распространенность ОА в популяции (6,43%) увеличивается с возрастом и достигает максимальных величин (13,9%) у лиц старше 45 лет [32]. По данным немецких ученых, опубликовавших статистику по ОА коленного и тазобедренного суставов, частота встречаемости ОА — 10 человек из 2230 и распространенность заболевания — от 0,5 до 36% в зависимости от возраста. Оценка результатов проводилась в 29 исследованиях на примере 14 стран Евразийского континента [53].
По данным ВОЗ, деформирующим артрозом суставов болеют более 12% населения земного шара (700 млн человек), он является причиной инвалидности и ухудшения качества жизни больных. По экспертным оценкам О.М. Фоломеевой и соавт. (2006), N. Bellamy и соавт. (2006), с 1990 г. до 2020 г. за счет увеличения продолжительности жизни и старения населения число больных OA может увеличиться вдвое. У лиц в возрасте до 45 лет распространенность ОА увеличивается на 57%, а у людей старше 65 лет достигает 90%. По данным О.М. Фоломеевой и соавт. (2003), Л.И. Алексеевой (2003), В.В. Поворознюк (2004), J. Pelletier и соавт. (2006), показатели временной и стойкой утраты трудоспособности при OA сопоставимы с таковыми при сердечно-сосудистой патологии.
Патогенетические аспекты
Долгие годы развитие ОА считали следствием процесса старения. В настоящее время взгляды на патогенез ОА существенно изменились. Предполагают, что патогенез ОА состоит из 2 компонентов: «патологического стресса», т. е. патологической нагрузки на сустав, которая может быть связана также с травмой и дисплазиями, и «патологического хряща», в формировании которого основная роль принадлежит нарушению метаболизма, в значительном числе случаев обусловленному старением [18, 52].
В основе заболевания лежит нарушение адаптации суставного хряща к механической нагрузке, прежде всего смещение баланса обмена хрящевой ткани в сторону катаболических процессов. В норме синтез и деградация элементов хряща находятся в сбалансированном состоянии. Изменения суставного хряща при ОА могут быть обусловлены как генетическими, так и разнообразными средовыми факторами, т. е. ОА — заболевание мультифакториальное [36].
В настоящее время полагают, что в основе прогрессирования дегенеративно-деструктивного процесса в суставах лежит множество сложно взаимодействующих друг с другом причин и механизмов, только частично связанных с возрастными изменениями. В последние годы получены доказательства влияния на развитие ОА генетической предрасположенности, биомеханических и метаболических изменений, локального воспаления и т. д. [35].
Главными этиологическими факторами развития гонартроза являются макро- и микротравмы коленного сустава, вызываемые интенсивными физическими нагрузками: спортивными, профессиональными, избыточной массой тела [31].
При этом происходит неравномерное распределение нагрузки по поверхности суставного хряща, и максимальное давление сосредоточивается на небольшой площади, в месте наибольшего сближения суставных поверхностей, приводя к дистрофии и дегенерации хряща.
В основе этих дегенеративных изменений лежит нарушение метаболизма хряща, сопровождающееся уменьшением содержания протеогликанов и разрывом коллагеновых волокон. В целом содержание протеогликанов в хрящевом матриксе достигает 3—10%. Основным протеогликаном хрящевой ткани является аггрекан, который собирается в агрегаты с гиалуроновой кислотой [7]. Крупные агрегаты протеогликанов чрезвычайно гидрофильны и связывают большую часть воды, содержащейся в хряще. На долю воды приходится приблизительно 70% общей массы суставного хряща. В нормальном, не поврежденном, хряще крупные гидрофильные агрегаты протеогликанов переплетены друг с другом и стянуты сетью волокон коллагена, придавая хрящу эластичность [11].
В нормальном хряще взрослого человека компоненты матрикса синтезируются хондроцитами с невысокой скоростью. Существует строгая регуляция скорости обновления матрикса — тонкий баланс между синтезом и разрушением. При О.А. наиболее выраженные патоморфологические изменения происходят в хрящевом матриксе. Функционально хондроциты, регулируя обмен, осуществляют, с одной стороны, синтез хрящевой ткани (анаболизм), а с другой — процессы деградации, т. е. распада (катаболизм) аггреканов (крупный протеогликан) и других компонентов хрящевой ткани. При О.А. баланс нарушается, усиливается как синтез, так и распад матрикса, причем преобладают катаболические процессы [33].
ОА характеризуется двумя параллельными процессами: деградацией и синтезом экстрацеллюлярного матрикса суставного хряща и субхондральной кости, основная роль в регуляции этих процессов принадлежит системе цитокинов [28].
Наиболее выраженные патоморфологические изменения при артрозе происходят в хрящевом матриксе. Они приводят к развитию прогрессирующей эрозии хряща и разрушению коллагеновых волокон II типа, а также деградации протеогликановых макромолекул. В основе нарушения метаболизма хряща лежат количественные и качественные изменения протеогликанов — белково-полисахаридных комплексов, обеспечивающих стабильность структуры коллагеновой сети, которая является основой хрящевого матрикса. Повреждение хряща при артрозе возникает в результате повышенного синтеза и освобождения из хондроцитов коллагеназы, стромелизина (металлопротеиназ), разрушающих протеогликаны и коллагеновую сеть (рис. 1). Возрастание в пораженном хряще синтеза коллагеназы и стромелизина может быть генетически обусловленным, оно находится под контролем цитокинов, освобождаемых из синовиальной мембраны, и приводит к дальнейшей деградации матрикса хряща [39].

Рис. 1. Морфологические изменения хряща при остеоартрозе.
В норме суставной хрящ эластичен и способен сжиматься, поверхности суставного хряща при высоких нагрузках давления покрываются особой смазкой, что обеспечивает плавное движение почти без трения. За эти свойства хряща ответственны, главным образом, коллаген, протеогликаны и гиалуроновая кислота. Форма и прочность хряща при растяжении обеспечиваются коллагеном II типа, который характерен только для суставов. Другим важным компонентом хряща является протеогликан (макромолекулы, в которых стержневой белок связан с одной или несколькими цепями гликозаминогликанов — ГАГ). ГАГ разделяют на две группы: несульфатированные (гиалуроновая кислота, хондроитин) и сульфатированные (хондроитинсульфат, кератансульфат). Совместно с коллагеновыми волокнами ГАГ обеспечивают устойчивость хряща к внешним воздействиям (рис. 2). При О.А. синтез хондроцитами ГАГ снижается. Снижается также и синтез коллагена II типа с повышением синтеза коллагена I, III, X типов. На ранних стадиях ОА происходит активация хондроцитов, которые вырабатывают ряд цитокинов (интерлейкин-1β, фактор некроза опухоли α) и ферментов (металлопротеиназ, индуцируемой синтетазы оксида азота, циклооксигеназы-2), способствующих разрушению хряща, развитию воспалительных изменений в пораженном суставе [29].

Рис. 2. Протеогликановый агрегат хрящевого матрикса.
Исследования последних лет свидетельствуют о роли провоспалительных цитокинов ИЛ-1β, ФНО-α в патогенезе ОА и иммунном характере воспаления. Оба цитокина в повышенных количествах выявлены в синовиальной оболочке, синовиальной жидкости и хряще у больных ОА. В хондроцитах эти цитокины повышают синтез протеаз, особенно металлопротеиназ, снижают синтез коллагена II и IХ типов, протеогликанов, тканевого ингибитора металлопротеиназ, стимулируют выработку кислородных радикалов, оксида азота, что способствует прогрессированию катаболических процессов в хряще [6].
Определенную роль в патогенезе ОА отводят воспалению, при этом причина его развития не всегда ясна. Воспаление участвует в деградации хряща за счет выработки провоспалительных цитокинов (интерлейкинов-1β и -6, фактора некроза опухоли и др.), которые способствуют высвобождению ферментов, повреждающих коллаген и протеогликаны, коллагеназ, стромелизина, а также простагландинов и ингибитора-1 активатора плазминогена (рис. 3) [16].

Рис. 3. Роль IL-1 в патогенезе остеоартроза (iNOS — индуцибельная синтетаза; NO — оксид азота; ММП — матриксная металлопротеиназа).
Эти факторы играют важную роль в моделировании воспаления и формировании боли. Начавшееся высвобождение биологически активных веществ поддерживает воспаление в тканях сустава при ОА, в результате чего в последующем происходит повреждение синовиальной оболочки сустава с развитием реактивного синовита и повышением продукции провоспалительных цитокинов.
Освобождающиеся протеогликаны, продукты распада хондроцитов и коллагена, являясь антигенами, могут индуцировать образование аутоантител с формированием локального воспалительного процесса [20]. Образовавшийся комплекс антиген— антитело действует на макрофаги в синовиальной мембране. Это способствует выделению большого количества медиаторов воспаления: кислородных радикалов, простагландинов, лейкотриенов и интерлейкинов. Медиаторы воспаления, обладая повреждающим действием, разрушают хондроциты. Вследствие этого возникает реактивный синовит. Воспаленная синовиальная оболочка в свою очередь выделяет биологические медиаторы воспаления, что поддерживает синовит и способствует деструкции хряща. Так образуется замкнутый круг воспалительной реакции [4].
В результате описанных процессов страдает образование синовиальной жидкости и эндогенной гиалуроновой кислоты. Ситуацию усугубляют медиаторы воспаления, которые способствуют повышению проницаемости сосудов и усиленной трансфузии плазмы в синовиальную жидкость, что приводит к уменьшению концентрации гиалуроновой кислоты и снижению вязкоэластических и лубрикантных свойств синовиальной жидкости и, как следствие, ее защитных возможностей [1]. Снижение вязкоэластических свойств синовиальной жидкости повышает чувствительность хряща к повреждению и другим воздействиям. Очевидно, что вязкоэластические свойства синовиальной жидкости, зависящие от гиалуроновой кислоты, играют важную роль в функционировании сустава как в норме, так и при патологии [43].
Анализируя данные многих авторов, В.Н. Павлова (1980), Т.Н. Брыленкова и соавт. (2000), С.Ф. Ермаков (2002) и др., при остеоартрите концентрация гиалуроновой кислоты в синовиальной жидкости снижается, а содержание протеогликанов в экстрацеллюлярном матриксе суставного гиалинового хряща возрастает, что приводит к ухудшению свойств и ускоренной деструкции хрящевой поверхности [46].
При ОА гиалуроновая кислота в синовиальной жидкости коленного сустава имеет массу молекулы меньше, чем в норме. Уменьшение концентрации гиалуроновой кислоты, нарушение синтеза этого вещества и свободной радикальной деградации сопровождаются уменьшением эластовискозного защитного эффекта — это требует изучения возможности дополнять синовиальную жидкость экзогенным гиалуронатом [51].
Клинические проявления остеоартроза
Поскольку суставной хрящ не содержит нервных окончаний, изменения в нем могут оставаться бессимптомными в течение длительного времени [25]. По данным многочисленных авторов (В.И. Мазурова (2005), Н.Г. Кашеварова, Л.И. Алексеева (2006), Н.А. Хитров (2009), Ю.А. Олюнин (2012)), первым и ведущим симптомом заболевания является боль. Обычно она усиливается под влиянием физической нагрузки и уменьшается после отдыха.
В настоящее время значительно расширены и уточнены представления о клинической картине О.А. Естественно, что боль в пораженных суставах — ведущий признак болезни, но важно обратить внимание и на предшествующие боли симптомы: скованность в пораженном суставе после покоя не более 30 мин, разной степени нарушения подвижности сустава при выполнении отдельных движений, ощущение нестабильности в пораженном суставе и функциональные ограничения, болевые точки вокруг сустава, увеличение объема сустава, крепитация при движении, тугоподвижность [21].
Оценка интенсивности болевого синдрома при ОА обязательна, так как именно боль является ведущей жалобой у большинства пациентов. Интенсивность боли можно определять по 4-балльной шкале вербальной оценки (ШВО): 0 баллов — нет боли, 1 балл — слабая, незначительная боль, 2 балла — умеренная боль, 3 балла — сильная боль, 4 балла — очень сильная боль. Оценка боли по ШВО проводится самим пациентом и носит субъективный характер. Более точное представление об интенсивности боли дает визуальная аналоговая шкала (ВАШ). Оценка боли по ВАШ проводится с помощью 100-миллиметровой линейки, не имеющей делений с одной стороны и градуированной миллиметровой шкалой с другой стороны. По этой линейке перемещается двусторонний бегунок — указатель. Отметка «0» означает отсутствие боли, отметка «100» — максимальную, нестерпимую боль.
Также среди субъективных опросников, заполняемых самими пациентами, наиболее распространенными являются шкалы для оценки нарушений при ОА: тазобедренного сустава — Hip disability and Osteoarthritis Outcome (HOOS), коленного сустава — Knee Injury and Osteoarthritis Outcome (KOOS), а также WOMAK — для тазобедренного и коленного суставов, OXFORD — для тазобедренного, коленного, плечевого и локтевого суставов. Большинство шкал, включающих объективную оценку функции суставов врачом, применяются в посттравматическом и послеоперационном периодах, но могут применяться и при ОА [9].
Газета «Новости медицины и фармации» 16 (635) 2017
Остеоартроз: лечение с позиций доказательной медицины

Авторы: Татьяна Чистик
Версия для печати
Среди многочисленных форм суставной патологии наиболее распространенной является остеоартроз (ОА) — хроническое прогрессирующее дегенеративное заболевание суставов, при котором происходит деградация суставного хряща, изменяется субхондральная кость и развиваются краевые остеофиты.
Первые признаки дистрофических нарушений в суставах встречаются уже у 30-летних людей. С возрастом наблюдается повышение частоты заболевания. По данным популяционных исследований, частота и распространенность ОА возрастают в 2–10 раз за период с 30 до 65 лет. Остеоартроз выявляется у большинства лиц старше 65 лет и практически у каждого человека после 75–80 лет.
Развитие ОА не влияет на жизненный прогноз пациентов, но является одной из основных причин преждевременной потери трудоспособности и инвалидности, сопровождается хроническим болевым синдромом, значительно снижающим качество жизни. Это диктует необходимость своевременной диагностики и применения современных методов терапии данной патологии. Однако сведения об эффективности и целесообразности различных методов лечения ОА отличаются большим разбросом, что привело к созданию рекомендаций, основанных на принципах доказательной медицины.
22 декабря в Киеве прошли научные чтения имени профессора Е.Т. Скляренко «Внедрение научных разработок в практику охраны здоровья», в рамках которых были рассмотрены актуальные вопросы травматологии и ортопедии, в том числе лечение остеоартроза с позиций доказательной медицины.
/u/0-3.jpg)
С докладом «Доказательная медицина и остеоартроз» выступил заведующий кафедрой травматологии и ортопедии Национального медицинского университета им. А.А. Богомольца доктор медицинских наук, профессор Бурьянов Александр Анатольевич.
В начале своего выступления профессор сообщил, что доказательная медицина (Evidence Based Medicine) — это раздел медицины, основанный на объективных, научно обоснованных фактах, которые предусматривают поиск, сравнение, обобщение и широкое распространение полученных доказательств для использования их в интересах больного.
Согласно правилам доказательной медицины эффективность и целесообразность применения определенной процедуры классифицируют следующим образом.
Класс I — наличие консенсуса и/или доказательств относительно эффективности, целесообразности и благоприятного действия процедуры.
Класс II — противоречивые доказательства и отсутствие консенсуса относительно эффективности и целесообразности применения процедуры:
► IIa — чаша весов доказательства/консенсус склоняется к эффективности и целесообразости применения про–цедуры;
► IIb — чаша весов доказательства/консенсус склоняется к неэффективности и нецелесообразности применения про–цедуры.
Класс III — наличие консенсуса и/или доказательств относительно неэффективности и нецелесообразности применения процедуры, а в отдельных случаях — даже ее вредности.
В свою очередь, степень доказанности эффективности и целесообразности применения процедуры подразделяют на три уровня.
Уровень В — данные, полученные в одном рандомизированном клиническом исследовании и/или в метаанализе, или в нескольких нерандомизированных исследованиях.
Уровень С — консенсус убеждений экспертов, основанный на результатах исследований и клинической практики.
В своей повседневной практике врач должен исходить из таких принципов научных доказательств, на которых базируется доказательная медицина сегодня. Во-первых, результаты научных исследований могут подлежать сомнению и изменениям на протяжении жизни одного поколения врачей. Во-вторых, научные данные не могут полностью заменить опыт квалифицированного врача, а лишь помогают в обосновании выбранного метода лечения. В-третьих, повышение информированности врачей относительно новых данных клинических исследований, особенно результатов мегаисследований, является крайне необходимым, поскольку такая информация должна доходить к врачу как можно быстрее и в доступной форме.
Далее докладчик уделил внимание актуальности проблемы остеоартроза, подчеркнув, что данное заболевание занимает около 80 % в общей структуре патологии суставов у лиц старше 60 лет, в 10–30 % случаев приводя к нетрудо–способности разного уровня. За последние 30–40 лет зафиксирован рост заболеваемости ОА в 9 раз.
Медико-демографические показатели в Европе и США свидетельствуют о продолжении процесса старения населения и увеличении численности лиц старше 60 лет. Прогнозируется, что в 2020 году количество населения этой возрастной группы увеличится вдвое. Помимо этого, отмечается «омоложение» остео–артроза — рост заболеваемости ОА среди трудоспособного населения, а также ее увеличение в детском и подростковом возрасте.
Следует отметить, что развитие остеоартроза во многом определяется особенностью строения гиалинового хряща и его низкой регенераторной способностью, что объясняется отсутствием камбиального слоя клеток надхрящницы, низким количеством клеточных элементов, синтезирующих межклеточный матрикс (коллаген и протеогликаны): 2–5 % хондроцитов и 98–95 % хрящевого матрикса, низкой митотической активностью хондроцитов: на 600–800 хондроцитов в зрелом хряще отмечается лишь 1 реакция митоза, и отсутствием сосудов в хряще, поскольку питание хряща на 60–80 % осуществляется из синовиальной жидкости и на 20–40 % — из капиллярной сосудистой сетки суб–хондральной кости.
Считается, что развитие остеоартроза связано с прямым механическим повреждением сустава (травма) либо опосредованным повреждением вследствие нарушения соотношения процессов гипоксии/реперфузии в васкуляризированных тканях сустава (перегрузки, воспаления, гемартрозы). Они запускают типичный патологический процесс с избыточной активацией реакций свободнорадикального окисления: биосинтеза простагландинов, лейкотриенов, тромбоксанов, радикалов жирных кислот, кетонов, альдегидов, кето–кислот, что приводит к повреждению и увеличению проницаемости клеточных мембран, окислительной модификации структурных белков, ферментов, биологически активных веществ. Формируется субклинический или хронический воспалительный процесс. В дальнейшем происходит прогрессирование дистрофически-деструктивных изменений в суставах с развитием остеоартроза.
Затем Александр Анатольевич рассказал о 5-ступенчатой рентгенологической классификации остеоартроза, предложенной J.H. Kellegren и J.S. Lawrence. Сегодня эта классификация дополнена клиническими, морфологическими показателями (Mohr W., 1984, Karree H.L., 1990, Scott V.S., 1999) и является общепринятой среди ревматологов и ортопедов-травматологов. Кроме того, существует классификация степени поражения суставного хряща на основании результатов артроскопии, созданная R.E. Outerbridge. В соответствии с ней выделяют 4 степени поражения суставного хряща:
Достаточно часто рентгенологическая картина остеоартроза и данные артроскопии не соответствуют друг другу. Так, при рентгенологическом исследовании может быть выставлена 0-я рентгенологическая стадия по Kellegren и Lawrence, тогда как при артроскопии выявляется 3-я степень по Outerbridge. Именно поэтому А.А. Бурь–яновым и соавт. была разработана рентгенологически-артроскопическая классификация остеоартроза. В ней учитываются: рентгенологическая стадия по Kellegren и Lawrence, этиология повреждения суставного хряща, данные компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ) и артроскопии с локализацией поражения хряща и его зоны, площадь поражения хряща и степень его поражения по Outerbridge. Соответственно этой классификации, в качестве примера, диагноз будет выглядеть следующим образом: посттравматический остеоартроз правого коленного сустава II степени по Kellegren и Lawrence. Хроническое повреждение суставного хряща медиального отростка бедренной кости в зоне М1, М3, М6, М7, площадь SM (до 6 см 2 ), 4-я степень по Outerbridge. Состояние после артроскопической ревизии правого коленного сустава (2009).
Для оценки эффективности диагностического метода В.В. Власовым в 2014 году были предложены следующие показатели: чувствительность метода, специфичность, точность, прогностичность положительного результата и прогностичность негативного результата.
Чувствительность метода (Se) — это процент действительно существующих патологических изменений в отдельной группе, выявленных при данном методе исследования. Она вычисляется в процентах по формуле Se = 100PS / (PS + NS).
Специфичность метода (Sp) — это процент здоровых структур, выявленных при исследовании как неповрежденных. Вычисляется в процентах по формуле Sp = NH / (NH + PH).
Общая ценность метода, или точность (Ас), — процент верных решений. Вычисляется в процентах по формуле Ас = 100(PS + NH) / (PS + NH + PH + NS).
Прогностичность положительного результата (PVP) — это вероятность наличия действительных патологических изменений в структуре при их выявлении во время данного исследования. –Вычисляется в процентах по формуле PVP = 100PS / (PS + PH).
Прогностичность негативного результата (PVN) — вероятность отсутствия патологических изменений в структуре, после того как они были выявлены во время диагностического исследования. Она вычисляется по формуле PVN = 100NH / (NH + NS).
С учетом этих показателей эффективность сонографической оценки структур сустава не имеет достаточной точности и чувствительности к повреждениям суставного хряща (25,3 и 25,5 % соответственно), но имеет достаточную информативность при повреждениях синовиального хряща и капсульно-связочных структур.
Магнитно-резонансная томография суставов более информативна в отношении выявления патологии менисков, синовита, синовиальных и капсульно-связочных структур, однако в отношении суставного хряща имеет низкую чувствительность и специфичность на уровне 35 %, что недостаточно для рекомендации МРТ как точного метода.
МРТ с артрографией обладает несом–ненно большими преимуществами, поскольку обеспечивает точную визуализацию хряща и его повреждений, особенно на ранних стадиях дегенеративного процесса. На 1-м этапе предусмотрено использование общепринятого протокола МРТ-исследования сустава. На 2-м этапе применяют внутрисуставное введение контраста (гадолиний 0,1 мл и 20 мл физиологического раствора) + внутривенно гадолиний 1 мл на 3 кг массы тела; на 3-м этапе — использование общепринятого протокола МРТ-исследования сустава. Данный метод исследования обладает наилучшими показателями чувствительности (99,3 %), специфичности (98,6 %), точности (98,8 %), прогностически позитивного (99,5 %) и прогностически негативного (98,7 %) результатов для суставного хряща.
Таким образом, в качестве стандарта диагностики остеоартроза основное место в алгоритме занимают рентгенография, сонография, МРТ и артроскопия. Однако необходимо помнить, что рентгенография на ранних стадиях заболевания малоинформативна. При сонографии сустава его визуализация ограничена и колеблется в диапазоне от 25 до 50 %. Высокой чувствительностью и специфичностью обладает МРТ сустава, но этот метод также малоинформативен на ранних стадиях ОА. Артроскопия сустава — золотой стандарт диагностики, однако ее отрицательной стороной является инвазивность метода и зависимость его проведения от анестезиолога.
Далее профессор сообщил об основных рекомендациях EULAR, OARSI, NICE относительно лечения остеоартроза. Согласно рекомендациям EULAR терапия остеоартроза должна начинаться с нефармакологического лечения, направленного на образование пациента, уменьшение избыточной массы тела и коррекцию питания. Также оно включает ортопедический режим, физические упражнения, витамино- и фитотерапию и такие физиотерапевтические методы лечения, как бальнеотерапия, электромагнитная и ультразвуковая терапия, электростимуляция, акупунктура, лазерная терапия, электрофорез и гидро–терапия.
В качестве фармакологического лечения рекомендуются противоартрозные препараты, которые подразделяются на препараты симптоматического действия (SMOADs): быстрого действия (нестероидные противовоспалительные препараты (НПВП), парацетамол, опиоидные анальгетики, глюкокортикостероидные препараты) и замедленного действия (SYSADOA: хондроитина сульфат, гиалуроновая кислота, неомыляемые соединения авокадо и сои, глюкозамин). Кроме того, целесообразно назначение препаратов патогенетического действия, структурно модифицирующих хрящ (DMADS). Показана антиоксидантная терапия, препараты, улучшающие микроциркуляцию, ингибиторы протеолитических ферментов и метаболическая терапия.
/u/4-1.jpg)
Интраартикулярное лечение включает хондропротекторы для внутрисуставного применения, противовоспалительную и антигомотоксическую терапию, глюкокортикостероидные препараты и лаваж. Хирургическое лечение — диагностически-лечебную артроскопию, лаваж, коррекционные остеотомии, эндопротезирование и артропластику суставов, артродез.
Артроскопия — золотой стандарт в диагностике и лечении ранних стадий остеоартроза крупных суставов и внутрисуставных повреждений. Благодаря артроскопии возможно осуществление таких методов лечения:
► парциальная менискэктомия при 2–3-й степени с использованием температурной модификации мягких тканей, в том числе разрушенного хряща;


