Гемолитико уремический синдром у детей и взрослых
Сотрудники «Новосибирского государственного медицинского университета» и «Детской городской клинической больницы № 3» города Новосибирск, подготовили статью на тему: гемолитико-уремический синдром. Возможная этиологическая роль инфекции, вызванной Campylobacter.
Учитывая высокую частоту развития при инфекциях, вызванных Campylobacter, таких аутоиммунных патологий, как синдром Гийена – Барре, реактивные артриты, сегодня не представляется возможным исключить аутоиммунный механизм развития ГУС при этих заболеваниях. Таким образом, роль Campylobacter в качестве нового потенциального бактериального агента ГУС, а также патогенез подобных состояний при кампилобактерных инфекциях нуждаются в дальнейшем изучении.
Тромботическая микроангиопатия (ТМА) представляет собой особый тип поражения сосудистой стенки мелкого калибра, главным образом проявляющийся в виде тромбоза и воспаления сосудов. Для этой группы заболеваний типичен ряд общих клинико-лабораторных признаков:
- наличие тромбов, образованных фибрином и тромбоцитами в микрососудах различных органов, что ведет к нарушению функции этих органов;
- тромбоцитопения;
- неиммунная (негативная по Кумбсу) гемолитическая анемия.
Среди форм ТМА вычленяют гемолитико-уремический синдром (ГУС) – состояние, при котором отмечается облигатное поражение почек с развитием острого почечного повреждения и нередко поражение других органов и систем. Обычно ГУС характеризуется тяжестью течения, когда необходимо проведение процедуры диализа и переливание компонентов крови, а также довольно высокой частотой развития тяжелых неврологических осложнений, включая острые нарушения мозгового кровообращения, судорожный синдром, кому. ГУС – одна из ведущих причин острого почечного повреждения у детей. Выделяемые по этиологическому принципу формы ГУС различаются и по патогенезу, и по прогнозу. Следовательно, вопросы этиологии и патогенеза ГУС весьма актуальны с позиции клинической практики, так как лежат в основе ранней и эффективной диагностики, прогнозирования рисков неблагоприятного исхода. Согласно современным представлениям, ГУС принято разделять на типичный (тГУС) и атипичный (аГУС), а также ГУС, ассоциированный с пневмококковой инфекцией (пГУС).
Типичный гемолитико-уремический синдром
Будучи наиболее распространенной формой данной патологии, тГУС составляет около 90% от всех случаев ГУС. Согласно данным литературы, общая частота заболеваемости равна 2,1 случая на 100 тыс. населения в год (у детей до 5 лет – 6,1 на 100 тыс. в год). В странах Америки и Европы ведущим этиологическим агентом, ответственным за развитие тГУС (около 90%), признана STEC-инфекция (англ. Shiga toxin-producing Escherichia coli), вызываемая энтерогеморрагическими кишечными палочками. Для стран Латинской Америки STEC-инфекция является эндемичной патологией, что объясняется тесным контактом местного населения с крупным рогатым скотом. Для европейского континента характерен меньший уровень заболеваемости STEC, а также протекание данных инфекций по типу вспышек. Последняя большая вспышка инфекции, вызванной STEC, была зафиксирована в Германии в 2011 г. и привела к заболеванию около 4 тыс. человек, у 800 заболевание осложнилось ГУС. Наиболее часто развитие ТМА вызывает серотип O157:H7. Способность секретировать Шига-токсин (токсин Шига, шига-подобный токсин – Stx), а значит, вызывать тГУС, обнаружена и у других серотипов STEC, в частности О26, О145, О121, О103, О111, О113, О104.
Вышеупомянутая вспышка ГУС в Германии была ассоциирована с E. сoli О104:Н4. Еще один общепризнанный этиологический агент тГУС – Stx, продуцируемый шигеллами серотипа I (Shigella dysenteriae). Данный возбудитель наиболее часто становится этиологическим агентом тГУС в странах Азии и Африки, а в других играет меньшую роль.
Помимо «классических» возбудителей тГУС описаны и другие микроорганизмы, способные продуцировать Stx. В частности, зафиксирована вспышка кишечной инфекции с развитием ГУС, обусловленная Stx-продуцирующим Citrobacter freundii. С нашей точки зрения, принятое в англоязычной литературе определение STEC-ГУС как тождественное для тГУС не совсем корректно, учитывая более широкий спектр возбудителей, способных индуцировать развитие тГУС.
В основе патогенеза тГУС лежит прямое повреждение токсином бактерий клеток эндотелия сосудов [22]. Сегодня к токсинам бактерий, способным индуцировать тГУС, относят Stx. Возбудителями, способными секретировать вышеупомянутые токсины, являются STEC и Shigella dysenteriae. Следует отметить, что изначально токсины, продуцируемые STEC, были названы веротоксинами. В дальнейшем доказано наличие двух различных типов веротоксинов, получивших порядковые номера 1 и 2 (V1, V2). Исследования показали высокое сходство веротоксинов с Шига-токсином, который секретируется шигеллами дизентерии первого типа. В результате этого название веротоксинов изменили на шигаподобные токсины (Stx). Stx 1 практически идентичен Шига-токсину (отличие в одной аминокислоте) и на 50% гомологичен Stx 2. Более высокой патогенностью обладает шигаподобный токсин Stx 2, значительно отличающийся по своей структуре от Шига-токсина. Выявлено, что инфекции, ассоциированные с кишечными палочками, продуцирующими Stx 2, чаще осложнялись развитием ГУС. Несмотря на это, с целью оптимизации терминологии произошло объединение понятий Шига-токсина и шигаподобных токсинов в единый термин Stx – Шига-токсин. Патогенез Stx-опосредованного ГУС сложен, многие аспекты остаются неясными по настоящее время. Ключевым звеном патогенеза данного состояния признана токсинемия. Проникновение Stx в кровь осуществляется из кишечника трансцеллюлярными путями при помощи клеток желудочно-кишечного тракта (энтероцитов). Дальнейшая транспортировка токсина кровью к органам-мишеням является предметом активной дискуссии. Проведенные исследования показали возможность Stx связываться практически со всеми клетками крови: эритроцитами, тромбоцитами, моноцитами.
Однако сегодня главную роль в транспортировке Stx принято отводить нейтрофилам, так как они наиболее полно и прочно связываются с токсином. Органы-мишени при ГУС определяются наличием и сродством специфических рецепторов к Stx в различных тканях. Наибольшее количество рецепторов присутствует в клетках эндотелия клубочков почек. Эти рецепторы имеют в 100 раз более высокий аффинитет, чем рецепторы нейтрофилов, что приводит к повреждению токсином почечного эндотелия и значительно меньшему повреждающему эффекту в кровяном русле. Следует отметить: в зависимости от типа Stx различен уровень токсичности для клеток эндотелия. Так, в эксперименте Stx 2 продемонстрировал токсичность в отношении эндотелия человека, в 1000 раз превосходящую токсичность Stx 1, что подчеркивает ведущую роль второго типа шигаподобного токсина в развитии ГУС. Связываясь со специфическими рецепторами, Stx способствует развитию лейкоцитозависимого воспаления и, в меньшей степени, инициализации апоптоза. Эти изменения приводят к активации эндотелиальных клеток, повышенной активации и адгезии тромбоцитов и, в конечном итоге, к тромбозу сосудов микроциркуляторного русла. Примечательно, что мелкие сосуды значительно чувствительнее к действию токсина, нежели эндотелий крупных сосудов.
Атипичный гемолитико-уремический синдром
Частота встречаемости аГУС – неуклонно прогрессирующего генетического заболевания – составляет, по разным оценкам, от 1 до 7 случаев на 1 млн населения, что позволяет отнести его к числу орфанных. На долю данной формы ТМА приходится менее 5% от всех регистрируемых случаев ГУС. В основе патогенеза лежит дефект белка – регулятора системы комплемента. Он приводит к избыточной активации альтернативного пути комплемента и, как следствие, к развитию всех вышеперечисленных симптомов, характерных для ТМА. Возраст дебюта, как правило, ранний, начиная с периода младенчества, но возможен и у детей дошкольного и школьного возраста.
Campylobacter и гемолитико-уремический синдром
В литературе появляются сообщения о новых бактериальных патогенах, которые могут быть
ассоциированы с развитием ГУС. Среди них Campylobacter, который считается одной из наиболее распространенных в мире бактериальных причин гастроэнтерита у людей. Учитывая миграцию населения, Campylobacter занимает, по разным оценкам, 2–4-е место в этиологической структуре диареи путешественников. По данным Всемирной гастроэнтерологической ассоциации, Campylobacter – один из наиболее часто выявляемых из кала микроорганизмов у детей до 2 лет. Известно более 15 видов и подвидов кампилобактерий, вызывающих заболевание у животных и человека, однако наибольшее значение в этиологии кампилобактериоза у людей имеют C. jejuni, C. coli, C. laridis, C. fetus. При этом подавляющее большинство случаев заболевания как у взрослых, так и у детей связано с C. jejuni. Тем не менее в Российской Федерации уровень лабораторной верификации остается низким, не отражая истинного значения этой инфекции в структуре заболеваемости кишечными инфекциями.
Возможность Campylobacter индуцировать развитие ГУС стала предметом активной дискуссии. Многие авторы признают данный возбудитель как этиологический агент ГУС. Зафиксированы случаи развития ТМА у пациентов с кампилобактерной инфекцией. Впервые развитие ГУС при кампилобактериозе зарегистрировано T. May и соавт. в 1986 г. Авторы из Франции наблюдали случай тяжелого колита у 4-летнего ребенка, в дальнейшем пациенту верифицирован диагноз ГУС, из фекалий выделен C. jejuni. В 1996 г. канадские исследователи описали случай развития ГУС у 14-летнего пациента с профузной водянистой диареей. На основании бактериологического обследования была исключена STEC-инфекция, из копрокультуры выделен C. upsaliensis, однако при диагностике методом полимеразной цепной реакции, а также при генетическом исследовании не обнаружено наличие Stx. В это же время зафиксирован случай развития ГУС у взрослого пациента во Франции, в качестве этиологического агента идентифицирован C. jejuni. В 2000 г. в Египте описан случай развития ГУС у 55-летней пациентки с водянистой диареей.. Бактериологическое исследование было отрицательным в отношении E. Coli O157:H7, возбудителем оказался Campylobacter.
Механизм развития ТМА при инфекциях, вызванных Campylobacter, не ясен до настоящего времени. В литературе отсутствуют свидетельства о продукции данным микроорганизмом Stx. В этой связи развитие ГУС при кампилобактерной инфекции объясняли коинфекцией с типичными возбудителями тГУС, а именно энтерогеморрагической Escherichia coli, не идентифицированной в силу разных причин. Однако накопленные наблюдения описывают не совсем типичную клинику для STEC – отсутствие выраженных признаков гемоколита, а нередко и изолированную водянистую диарею. Кроме того, современные наблюдения Campylobacter-ассоциированного ГУС подверглись тщательному исключению наличия энтерогеморрагической Escherichia coli и других классических возбудителей тГУС. Таким образом, данная теория не в силах объяснить развитие ГУС при кампилобактерной патологии. Возможность реализации Stx-механизма при инфекциях, вызванных Campylobacter, может объясняться следующими особенностями. Способность секретировать Stx 2 у энтерогеморрагической Escherichia coli кодируется не ядерными генами, а лямбдовидными бактериофагами.
Представляется потенциально возможной межвидовая горизонтальная передача данных генов. Предположительно, Campylobacter мог приобрести способность к секреции Stx в ходе эволюционных процессов, но это не имеет достоверного подтверждения. Предприняты попытки объяснить развитие ГУС при диареях, вызванных Campylobacter, нейраминидазным механизмом, характерным для пГУС, с учетом способности кампилобактери к секреции данного фермента. Для этого механизма, как упоминалось выше, характерно наличие иммунного гемолиза. Однако практически во всех описаниях ГУС, вызванного кампилобактерной инфекцией, отсутствует информация о характеристике пробы Кумбса в каждом конкретном случае, что не позволяет судить о наличии иммунного механизма гемолиза. В вышеуказанных наблюдениях упоминаются “red cell fragments” (шизоциты), что свидетельствует о наличии неиммунного микроангиопатического гемолиза, но данный факт не исключает сочетание двух механизмов развития гемолитической анемии. Вышесказанное не позволяет исключить нейраминидазный механизм развития ГУС при инфекциях, вызванных Campylobacter.
Заключение
ГУС представляет собой полиэтиологичное состояние с различным патогенезом и отдаленным прогнозом. Случаи ГУС, ассоциированные с «новыми» патогенами, в том числе с Campylobacter, нуждаются в детальном изучении и описании, так как понимание патогенеза и этиологии ГУС во многом лежит в основе ранней и эффективной диагностики и лечения.
Карпович Г.С., Краснова Е.И., Васюнин А.В., Комиссарова Т.В., Ениватова Л.И., Гайнц О.В.
Гемолитико-уремический синдром
В 1955 г. C. Gasser с соавторами описали наблюдавшееся ими у 5 детей заболевание, которое представляло собой сочетание острой почечной недостаточности (ОПН) с гемолитической анемией и тромбоцитопенией, развивающимися на фоне инфекционной диареи (E. coli, Sh. dysenteriae, S. pneumoniae), и назвали его гемолитико-уремическим синдромом (ГУС) [1].
Эпидемиология
С данным синдромом должен быть знаком каждый педиатр, ведь ГУС является основной причиной развития ОПН у детей до 3-х лет. Частота возникновения ГУС у детей данного возраста составляет 2–3 случая на 10 тысяч детей. Причем в разных регионах заболеваемость типичным ГУС (тГУС) значительно варьирует (в зависимости от численности сельского населения, особенностей водоснабжения — в Аргентине и Уругвае эшерихиоз эндемичен, поэтому частота достигает 10 случаев на 100 тыс. населения в год; в более холодных регионах заболеваемость также выше — в Шотландии, по сравнению с Англией, в 2 раза выше — 3,4 vs 1,54 на 100 тыс. населения в год). Для тГУС чаще характерны эпидемические подъемы заболеваемости, но могут быть и спорадические случаи (более характерно для атипичного ГУС) [2]. Резервуаром инфекции являются фекалии крупного рогатого скота (E. coli O157 длительно выделяют в стуле Shiga like toxin (Stx) 2 типа). Человек заражается при употреблении сырой телятины, непастеризованного молока, загрязненных фруктов и овощей, контаминированной воды из колодца и водоемов, а также при неисправностях водопровода. Прямой контакт детей с животными или их испражнениями и передача от человека к человеку являются не менее важными механизмами передачи этой инфекции [2].
Классификация
Официальной классификации ГУС нет. По причинам возникновения выделяют инфекционные и неинфекционные формы (рис. 1). К инфекционным формам ГУС относят:
- ГУС, ассоциированный с шига-токсином (Sh. dysenteriae тип 1);
- ГУС, ассоциированный с микроорганизмами, секретирующими нейраминидазу (S. pneumoniae);
- ГУС, ассоциированный с ВИЧ-инфекцией, и др.
К неинфекционным формам относят идиопатический ГУС, наследственный ГУС (связанный с аномалиями ADAMTS-13), лекарственно-индуцированный ГУС (прием ингибиторов mTOR или ингибиторов VEGF) и другие формы.

Рис. 1. Классификация ГУС.
Помимо вышеописанной классификации, ГУС можно отнести к первичным тромботическим микроангиопатиям (ТМА), этиология и патогенез которых установлены:
- ГУС, индуцированный инфекцией или ассоциированный с диареей (тГУС, ГУС-(D+));
- Атипичный ГУС, обусловленный генетическими нарушениями или изменениями иммунной системы, приводящими к патологии системы комплемента (аГУС, ГУС-(D–));
- Тромботическая тромбоцитопеническая пурпура (ТТП, болезнь Мошковица), связанная с аномалиями фермента ADAMTS-13 (врожденная или приобретенная).
Патогенез
I. Типичный ГУС
Основным фактором, инициирующим развитие тГУС, который обусловливает до 80 % от общего числа случаев заболевания, является энтерогеморрагическая кишечная палочка (E. coli, EHEC, серотип О157:Н7), синтезирующая шигаподобный токсин (веротоксин 1 и/или 2 типа) [3, 4]. Данный штамм обладает высокой патогенностью для человека (для заражения достаточно 10 3 микроорганизмов), однако диарея развивается только в каждом 10-м случае (рис. 2).
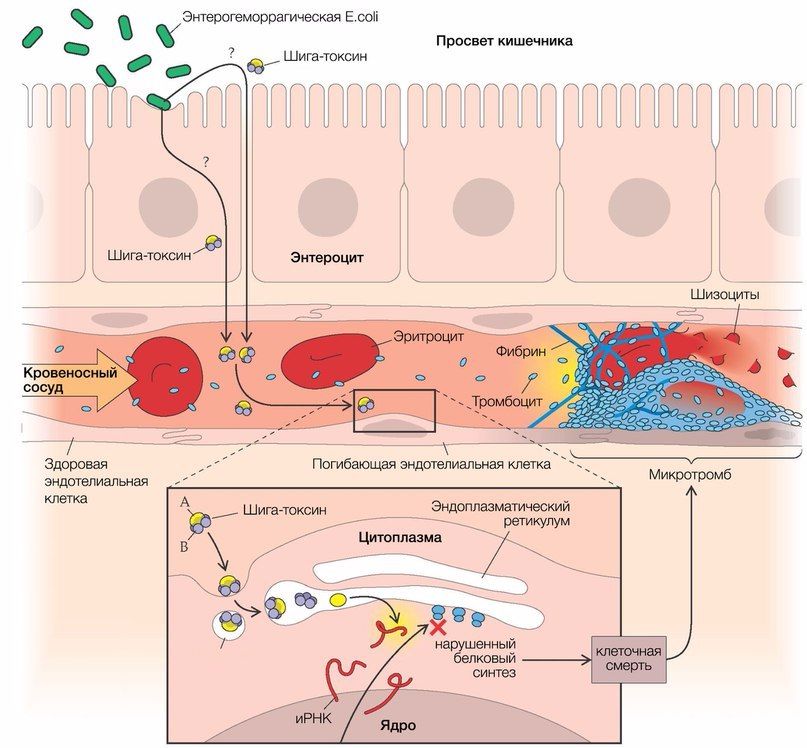
Рис. 2. Патогенез тГУС, ассоциированного с EHEC.
После попадания E. coli в кишечник она связывается с ворсинками подвздошной кишки и эпителиальными клетками пейеровых бляшек при помощи специального белка, вызывая в конечном итоге гибель клеток с развитием диареи, переходящей в гемоколит (его возникновение связано с веротоксином, который способен повреждать сосуды слизистой оболочки кишечника). Шигаподобный токсин (SLT, Stx), высвобождающийся из кишечника, попадает в печень, где часть его метаболизируется, а другая часть попадает в системный кровоток, вызывая повреждение эндотелия органов-мишеней (легкие, почки, головной мозг) [3].
SLT транспортируется в крови в основном нейтрофилами, но может перемещаться по системному кровотоку и при помощи моноцитов, тромбоцитов и/или их комплексов (липополисахарид кишечной палочки связывается с тромбоцитами, вызывая их активацию и агрегацию). За счет субъединицы В Stx имеет высокое сродство к мембраносвязанным гликосфинголипидам — Gb3/Gb4-рецепторам (в 100 раз выше, чем таковое с нейтрофилами).
В связи с этим повреждение эндотелия ярко выражено в мелких сосудах почек, но не в крупных сосудах других «возможных» органов-мишеней (экспрессия рецепторов Gb на мембранах эндотелиальных клеток почечных клубочков в 50 раз выше, чем в других тканях и органах) [3, 5]. Помимо клеток эндотелия почечных клубочков, мезангиальных клеток, подоцитов, Gb-рецепторы в большом количестве синтезируются на мембранах нейронов и глиальных клеток. После проникновения Stx (за счет А субъединицы) внутрь клетки происходит блокирование синтеза белков путем инактивации рибосомальных субъединиц (60S) с последующим апоптозом этих клеток.
Помимо этого, ЛПС, концентрация которого в крови прямо коррелирует с таковой у шига-токсина, обусловливает повышенную продукцию провоспалительных цитокинов — интерлейкинов 1, 6, 8, а также фактора некроза опухоли-альфа (TNF-α). Те, в свою очередь, повышают экспрессию рецепторов на мембранах связывающих их моноцитов, приводя тем самым к более выраженному токсическому эффекту Stx.
Патогенез ГУС, вызванного Shigella dysenteriae 1 типа, схож с таковым у E. coli (рис. 3, 4, 5). Однако этот тип ГУС протекает тяжелее, чем ГУС, ассоциированный с шигаподобным токсином E. coli. Связано это, скорее всего, с липополисахаридным эндотоксином шигелл, который путем сложного взаимодействия с рецепторами TLR4 (на мембранах клеток) и NLR 1, 2 (Nod like receptors, расположены внутриклеточно) вызывает активацию сигнального пути NF-kB, что, в свою очередь, приводит к массивному выделению интерлейкина 8, являющегося мощным хемокином для нейтрофилов, макрофагов и лимфоцитов [5]. Активированные нейтрофилы путем массивного выброса воспалительных цитокинов, помимо повышения секреции специфических рецепторов на мембранах эндотелиоцитов, вызывают активацию перекисного окисления липидов (ПОЛ), приводящего к повреждению не только эндотелия, но и эритроцитов, а также активацию лизосомальных ферментов, например, эластазы или α1-антитрипсина, которые также усугубляют эндотелиальное повреждение.
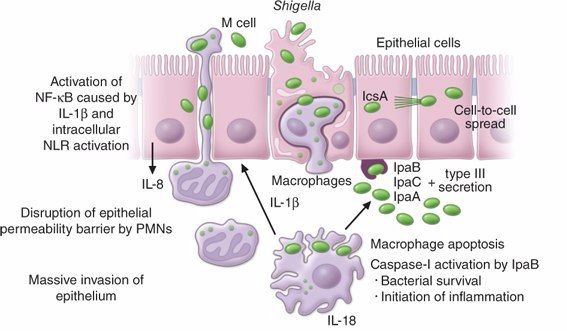
Рис. 3. Патогенез тГУС, ассоциированного с Shigella dysenteriae.
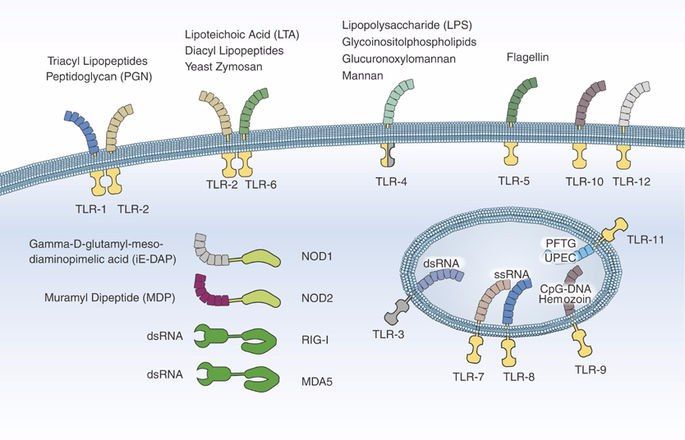
Рис. 4. Рецепторы TLR4 и NOD 1-2, через которые Shigella dysenteriae активирует сигнальный путь NF-kB.
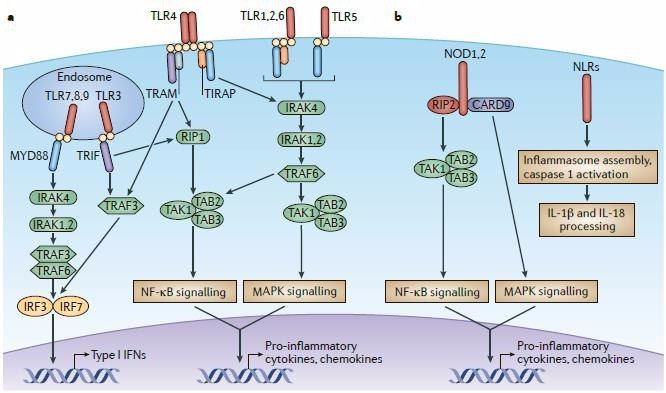
Рис. 5. Молекулярная основа патогенеза тГУС, ассоциированного с Shigella dysenteriae.
ГУС, ассоциированный со Streptococcus pneumoniae, имеет несколько другой патогенез (рис. 6). Нейраминидаза S. pneumoniae атакует ацетилнейраминовую кислоту поверхности эндотелиальных клеток почечных клубочков, эритроцитов и тромбоцитов, обнажая при этом T-антиген (антиген Томсена-Фриденрайха) [6]. После «открытия» этих антигенов происходит усиление продукции Ig класса M, что, в свою очередь, приводит к агглютинации тромбоцитов и эритроцитов. По сути, эндотелий почечных клубочков повреждается как напрямую, так и иммуноопосредованно.
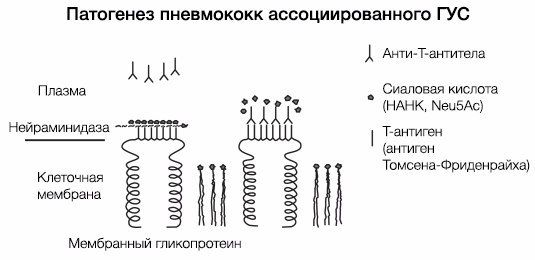
Рис. 6. Патогенез тГУС, ассоциированного со Streptococcus pneumoniae.
В связи с этим происходит локальное изменение реологических свойств крови. Так называемый «shear stress» (связан с различной скоростью движения слоев крови), возрастающий при повреждении эндотелиальных клеток, помимо увеличения продукции NO (связано с раздражением механорецепторов), активирующего оксидативный стресс и инициирующего апоптоз эндотелиоцитов, также приводит и к агглютинации тромбоцитов. Основным звеном этой агглютинации является фактор Виллебранда (ФВ), который обычно накапливается в альфа-гранулах тромбоцитов и в тельцах Вайбеля-Паладе эндотелиальных клеток. Как говорилось выше, раздражение сосудистой стенки почечных клубочков путем воздействия на их стенку оксида азота, а также возрастающего касательного напряжения («shear stress») приводит к высвобождению ФВ, который способен поддерживать активацию и агрегацию тромбоцитов и тромбообразование в почечных клубочках [7].
II. Атипичный ГУС
Патогенез атипичного ГУС (аГУС) разительно отличается от тГУС [2, 4, 8]. В его основе лежат мутации регуляторных белков системы комплемента (чаще всего аГУС ассоциирован с мутацией комплементарного фактора Н (CFH), на втором месте располагается мембранный кофакторный протеин (MCP), тройку замыкает комплементарный фактор I (CFI)).
При активации комплемента образуется C3-конвертаза, расщепляющая C3 на малый (С3а) и большой (C3b) фрагменты, который и опсонизируется на поверхности микробной клетки и формирует мембраноатакующий комплекс (МАК), состоящий из C5b, C6, C7, C8 и C9, что приводит к осмотическому лизису этой клетки. Для того, чтобы активированная система комплемента не уничтожила собственные клетки, на их поверхности расположены белки-регуляторы (DAF и CR1); помимо этого, часть таких белков синтезируется в печени и циркулирует в плазме крови в неактивном состоянии. К таким белкам относят комплементарный фактор H (CFH), фактор I (CFI) и мембранный кофакторный протеин, закрепленный на поверхности клеток (CD46). Фактор I, главный из вышеперечисленных факторов, расщепляет C3b и C4b. Фактор Н и CD46 являются кофакторами фактора комплемента I (рис. 7). Первый из них связывается с гликозаминогликанами собственных клеток организма, отсутствующими на мембранах бактериальных клеток, а также ингибирует активность C3-конвертазы [8, 9]. При мутации данных регуляторных белков происходит утрата защиты эндотелиальных клеток от повреждения конечными продуктами активации альтернативного пути комплемента (рис. 8).
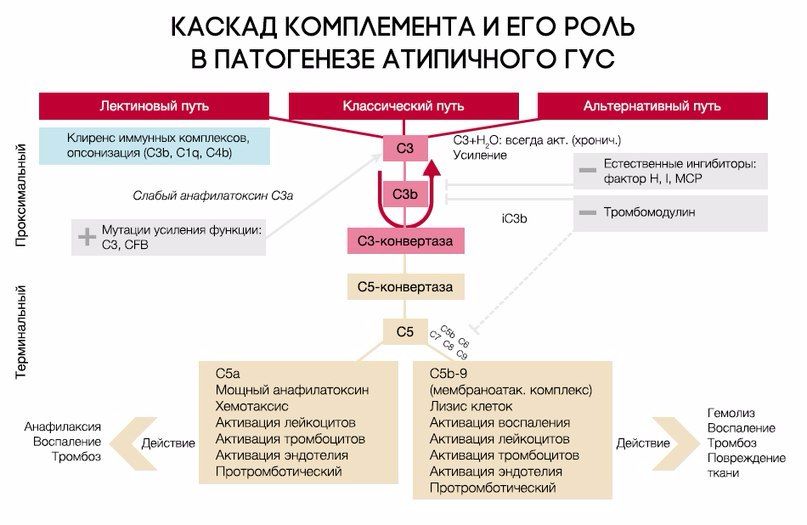
Рис. 7. Нормальная регуляция системы комплемента.
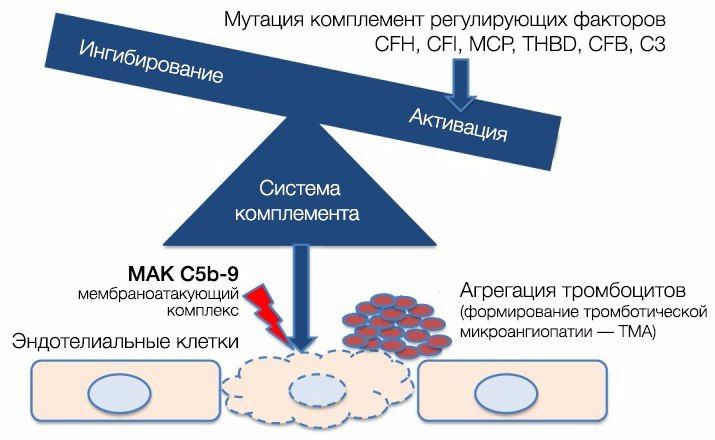
Рис. 8. Патогенез аГУС.
Клиническая картина
В течении тГУС условно можно выделить 2 периода [2, 4, 10]. Продромальный период характеризуется диареей, в ⅔ случаях диарею может сопровождать рвота. Гемоколит, характерный для тГУС, ассоциированного с шига-токсином, обычно развивается у каждого третьего больного через 2–3 дня после появления диареи.
Развернутая клиническая картина тГУС манифестирует в среднем на 5–6 день от начала диареи. Клиника крайне неспецифична. Бледность кожных покровов, общее недомогание, слабость, кожный геморрагический синдром в виде петехиальной сыпи или пурпуры, изменение цвета и уменьшение количества мочи после «кровавой» диареи должны насторожить врача в отношении тГУС (чаще всего диагностируется олигоанурическая стадия ОПН, требующая немедленного диализа) [2].
Ввиду частой гиподиагностики адекватный контроль регидратации может отсутствовать, поэтому дополнительным признаком тГУС у детей можно считать артериальную гипертензию, которая отличается упорным течением и плохо поддается терапии. После восстановления нормального диуреза может отмечаться второй подъем АД, связанный с избыточной выработкой ренина [4, 10].
Поражение ЦНС в виде генерализованных судорог, нарушения сознания вплоть до комы развивается в каждом четвертом случае и характеризует тяжесть течения тГУС.
Клиника аГУС имеет ряд особенностей [9, 11]. Для аГУС характерно очень раннее начало (начиная с 2 месяцев при мутации CFI, c 6 месяцев при мутации CFH). Чаще всего аГУС манифестирует неспецифическими симптомами в виде общей слабости, недомогания без предшествующей этим симптомам диареи (при ее наличии затрудняется дифференциальный диагноз с тГУС). Возможно развитие гриппоподобного синдрома. У взрослых клиника может развиваться стерто, при этом классическая триада ГУС имеет слабую выраженность. Возможно развитие неполной триады без тромбоцитопении [11]. Также для аГУС характерен семейный характер заболевания (в 25 % случаев имеется отягощенный наследственный анамнез). Большинство пациентов имеют выраженный отечный синдром вплоть до анасарки даже при отсутствии нефротического синдрома и ОПН. Также для больных с аГУС характерна АГ, связанная с перегрузкой объемом при манифестирующей ОПН или возникающая вследствие активации РААС, вызванной ишемией почечной ткани, обусловленной тромботической микроангиопатией. В отличие от тГУС, для атипичной формы характерно развитие кардиомиопатии с признаками острой СН. Описаны случаи развития острого панкреатита вплоть до панкреонекроза. В общем и целом клиника аГУС отличается яркой вариабельностью симптомов, что затрудняет ее своевременную диагностику (характерно рецидивирование).
Диагностика
Лабораторная диагностика как типичного, так и атипичного ГУС основана на выявлении признаков тромботической микроангиопатии:
- гемолитическая анемия — уровень гемоглобина ниже 90 г/л, выраженный ретикулоцитоз. Помимо этого, в крови могут появляться остатки эритроцитов — шизоциты (больше 1 %). Разрушение эритроцитов происходит из-за механического повреждения нитями фибрина при их прохождении через тромбированные сосуды почечных клубочков [2, 4, 10];
- тромбоцитопения ниже 150 тыс/мм 3 ;
- выраженный лейкоцитоз выше 20 х 10 9 /л; характеризует тяжесть ГУС.
Помимо этого, к неспецифическим признакам гемолиза эритроцитов можно отнести повышенный уровень ЛДГ, уменьшение уровня свободного гаптоглобина, гипербилирубинемию (за счет непрямой фракции). При проведении прямой пробы Кумбса результат будет отрицательным как у тГУС, так и аГУС.
Система диагностики ОПН, согласно критериям AKIN, основана на исследовании концентрации креатинина в сыворотке крови, СКФ, рассчитанной по формуле MDRD или CKD-EPI, а также на объеме мочи в течение суток. Для достоверной диагностики анурической стадии ОПН при подозрении на ГУС возможно выявление ранних признаков почечного повреждения (повышение уровня цистатина С, NGAL), а также повышения уровня калия крови выше 6 ммоль/л.
С целью подтверждения ГУС, связанного с шига-токсином, при наличии симптомов со стороны ЖКТ необходимо провести:
- посев кала на среду МакКонки для выявления серотипа E. coli O157:H7;
- определение шига-токсина в кале методом ПЦР или его выявление в сыворотке крови;
- возможно определение антител к липополисахариду эндемичного для данного региона серотипа E. coli.
Для исключения тромботической тромбоцитопенической пурпуры (ТТП) всем больным с характерной для ГУС клинической картиной необходимо определение активности ADAMTS-13 (менее 5 %). Для пациентов с аГУС типично снижение данного показателя, однако он в любом случае будет выше 10 % (в норме составляет 80–110 %) [10, 12].
Если при госпитализации больного в его анамнезе были выявлены предшествующие тромботические микроангиопатии, необходимо исследовать кровь на содержание С3 и С4 компонентов комплемента, а также на аутоантитела к фактору Н (анти-FH-антитела) [12]. Помимо этого, необходимо проведение дифференциальной диагностики со системными заболеваниями соединительной ткани (рис. 9). Развитие характерного симптомокомплекса во время беременности требует исключения специфической акушерской патологии.

Рис. 9. Дифференциальная диагностика ГУС.
Лечение
Относительно специфическое лечение разработано только для атипичной формы ГУС [2, 11, 12, 13]. В настоящее время единственным допущенным до применения ингибитором системы комплемента является экулизумаб (рекомбинантное моноклональное антитело против компонента комплемента С5). Данный препарат блокирует расщепление С5 компонента комплемента (С5а — провоспалительный, C5b — протромботический компонент) и формирование на мембране собственных клеток МАК C5b-9.
Клинические испытания показали, что в профилактике и лечении аГУС экулизумаб оказался более эффективен, чем плазмаферез. Однако наилучшей схемой лечения считается введение препарата на фоне проведения плазмафереза, так как последний удаляет часть препарата из циркуляции, тем самым предотвращая развитие побочных реакций.
Введение свежезамороженной плазмы (СЗП) не предотвращает развитие терминальных стадий ХБП у больных с аГУС [11, 12, 13]. Ее использование оправдано ввиду того, что СЗП является источником нормальных комплементарных факторов CFH и CFI. Как и в ситуации с экулизумабом, введение СЗП лучше сочетать с плазмаферезом (удаляются мутантные комплементарные факторы и анти-CFH антитела; удаление части плазмы предотвращает гиперволемию и следующую за этим острую сердечную недостаточность). Ввиду генетической детерминированности аГУС высок риск развития рецидива. Это, в свою очередь, требует проведение адекватной профилактической терапии, включающей в себя санацию очагов хронической инфекции, а также проведение своевременной вакцинопрофилактики. Трансплантация почки как метод лечения аГУС не имеет на данный момент широкой доказательной базы (описано всего 3 случая пересадки) [2]. Риск возврата аГУС сразу после трансплантации чрезвычайно высок, особенно у пациентов с мутацией комплементарного фактора Н.
Консервативное лечение тГУС заключается в проведении корректной регидратационной терапии [2, 4, 10]. Как говорилось выше, неспецифичность клинической картины обусловливает высокий процент гиподиагностики, в связи с чем следующая за этим попытка коррекции водно-электролитного баланса оказывает отрицательный эффект (например, перегрузка объемом приводит в итоге к развитию острой сердечной недостаточности и активации РААС (гиперренинемии) — формируется резистентная к проводимой терапии артериальная гипертензия. Использование петлевых диуретиков, например, фуросемида, не оправдано; предпочтение стоит отдавать гемодиализу (на фоне гиперкалиемии или метаболического ацидоза) ввиду того, что диализ чаще всего начинается в олигоанурической стадии ОПН [2, 4]. При развитии анемии тяжелой степени (Hb ниже 70 г/л) показано переливание эритроцитарной массы. Антибиотики не являются основным компонентом терапии тГУС. Однако раннее назначение цефалоспоринов III поколения или фторхинолонов снижает риск развития тГУС, ассоциированного с S. dysenteriae типа 1.
Гемолитико-уремический синдром
Гемолитико-уремический синдром – острое патологическое состояние, характеризующееся одновременным развитием микроангиопатической гемолитической анемии, тромбоцитопении и азотемии. Гемолитико-уремический синдром может проявляться кровавой диареей, абдоминальными болями, бледностью и иктеричностью кожи и склер, пастозностью лица, петехиями на коже, анурией, поражением ЦНС, печени, поджелудочной железы и сердца. Диагноз гемолитико-уремического синдрома основан на характерных клинических признаках, результатах общего и биохимического анализа крови и мочи, коагулограммы, бакпосева кала. Лечение гемолитико-уремического синдрома включает патогенетическую, симптоматическую и заместительную терапию.
МКБ-10
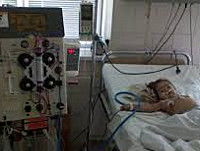
Общие сведения
Гемолитико-уремический синдром (болезнь Гассера) – тяжелое полиэтиологическое расстройство, проявляющееся сочетанием неиммунной гемолитической анемии, тромбоцитопении и острой почечной недостаточности. Гемолитико-уремический синдром наблюдается преимущественно у детей грудного и младшего возраста (с 6 мес. до 4 лет), но также встречается у детей старшего возраста и редко у взрослых. Ежегодно в расчете на 100 тыс. детского населения регистрируются 2-3 случая гемолитико-уремического синдрома у детей до 5 лет и 1 случай у детей до 18 лет. Поскольку гемолитико-уремический синдром – одна из частых причин острой почечной недостаточности у детей, то от своевременности его диагностики и лечения зависит исход заболевания.

Причины
У детей частыми причинами гемолитико-уремического синдрома являются острая кишечная инфекция (90%) и инфекции верхних дыхательных путей (10 %).
Основное значение в развитии Д+ гемолитико-уремического синдрома имеет энтерогеморрагическая Е. coli, продуцирующая специфический шига-подобный веротоксин, способный избирательно повреждать эндотелиальные клетки сосудов почек и головного мозга. Наибольшее сродство веротоксина с эндотелием капилляров почек наблюдается у детей первых 3 лет жизни. Веротоксин вызывает эндотелиальный апоптоз и лейкоцитозависимое воспаление, а также запускает цепь патологических реакций, приводящих к гемолизу эритроцитов, агрегации и деструкции тромбоцитов, локальной активации процесса коагуляции и внутрисосудистого отложения фибрина, развитию ДВС-синдрома.
Такими же свойствами обладает шигатоксин S. dysenteriae I типа. Развивающиеся микроциркуляторные нарушения (микроангиопатическая гемолитическая анемия, тромбоцитопения и микротромбозы) приводят к ишемическим изменениям в органах мишенях. При гемолитико-уремическом синдроме на фоне ОКИ наиболее часто поражаются капилляры клубочков почек, что может приводить к снижению скорости гломерулярной фильтрации, ишемии или некрозу клубочков, вторичной дисфункции или некрозу почечных канальцев, при массивном поражении – к ОПН.
Заражение энтерогеморрагической Е. coli может произойти при контакте с животными (кошками, крупным рогатым скотом) или инфицированным человеком; употреблении недостаточно термически обработанных мясных изделий, непастеризованных молочных продуктов, фруктовых соков, загрязненной воды. Для гемолитико-уремического синдрома характерна сезонность: на фоне ОКИ – преимущественно теплое время года (июнь-сентябрь), на фоне вирусных инфекций – зимне-весенний период.
Д- гемолитико-уремический синдром может быть постинфекционным, лекарственным, поствакцинальным, наследственным, связанным с системными заболеваниями соединительной ткани, идиопатическим. В 40% случаев развитие Д- гемолитико-уремического синдрома обусловлено респираторной инфекцией, возбудителем которой является S. pneumoniae, разрушающий мембраны эритроцитов, тромбоцитов и эндотелиоцитов с помощью фермента нейраминидазы. Вирусы ветряной оспы, ВИЧ, гриппа, Эпштейна-Барра, Коксаки также могут быть причиной гемолитико-уремического синдрома.
Установлена связь между развитием гемолитико-уремического синдрома у взрослых и употреблением некоторых медикаментов (циклоспорина А, митомицина С, эстроген – содержащих контрацептивов, противоопухолевых препаратов), трансплантацией костного мозга, злокачественными новообразованиями, системной красной волчанкой и антифосфолипидным синдромом, беременностью. Выявлены семейные случаи гемолитико-уремического синдрома с аутосомным типом наследования обусловленные дефектом системы комплемента, нарушением обмена простациклина, недостаточностью антитромботических факторов и др.
В основе гемолитико-уремического синдрома может лежать активация тромбоцитов иммунными комплексами (например, комплексом антиген – антитело после прививок живыми вакцинами против полиомиелита, против ветряной оспы, против кори, АКДС).
Классификация
В зависимости от этиологии и клинических особенностей разделяют гемолитико-уремический синдром диареяассоциированный – Д+ (типичный) и не ассоциированный с диареей – Д- (спорадический или атипичный). Д+ гемолитико-уремический синдром чаще встречается у детей раннего и младшего возраста, является эндемическим (распространен в Поволжье, Московском регионе); недиарейный – более свойственен детям старшего возраста и взрослым.
По тяжести течения выделяют легкую и тяжелую формы гемолитико-уремического синдрома.
- Легкая форма гемолитико-уремического синдрома подразделяется на тип А (анемия, тромбоцитопения и азотемия) и тип Б (триада симптомов в сочетании с судорожным синдромом или артериальной гипертензией);
- Тяжелая форма – на тип А (триада симптомов в сочетании с анурией длительностью более суток) и тип Б (триада симптомов в сочетании с анурией, артериальной гипертензией и судорожным синдромом).
Симптомы гемолитико-уремического синдрома
В клинической картине гемолитико-уремического синдрома различают продромальный период, разгар заболевания и восстановительный период. Продолжительность продромального периода составляет от 2 до 7 суток. Для него характерно появление признаков поражения ЖКТ или дыхательных путей.
Гемолитико-уремический синдром на фоне ОКИ, вызванной энтеропатогенной Е. coli, имеет ярко выраженную симптоматику. Развиваются симптомы гастроэнтерита или колита (часто кровавая диарея), тошнота, рвота, абдоминальные боли, лихорадка. Постепенно общее состояния ребенка ухудшается, повышенная возбудимость сменяется вялостью.
В период разгара гемолитико-уремического синдрома превалируют проявления гемолитической анемии, тромбоцитопении и ОПН: бледность и иктеричность кожного покрова, склер и слизистых оболочек; пастозность век, голеней; кожный геморрагический синдром в виде петехий или экхимозов, иногда – носовые кровотечения, в тяжелых случаях – снижение диуреза (олигурия или анурия). Тяжесть и продолжительность дизурии зависит от степени и глубины повреждения почек.
Гемолитико-уремический синдром может проявляться полиорганной патологией: поражением ЦНС, печени, поджелудочной железы, сердца, артериальной гипертензией. В 50% случаев гемолитико-уремического синдрома наблюдаются неврологические нарушения: подергивания мышц, гиперрефлексия, децеребрационная ригидность, гемипарезы, судороги, ступор, кома (особенно выраженные у детей первых лет жизни). Выявляются гепатоспленомегалия, кардиомиопатия, тахикардия, аритмия.
Продолжительность гемолитико-уремического синдрома обычно составляет 1-2 недели, затем наступает стабилизация и в 70% случаев – постепенное восстановление нарушенных функций: улучшение выделения мочи, повышение уровня тромбоцитов, нормализация уровня гемоглобина. При тяжелом течении наступает либо летальный исход вследствие экстраренальных поражений, либо формирование ХПН.
Диагностика
Диагноз гемолитико-уремического синдрома основан на выявлении характерных клинических признаков, осложняющих течение ОКИ или ОРВИ: гемолитической анемии, тромбоцитопении, ДВС-синдрома, азотемии.
При гемолитико-уремическом синдроме в крови обнаруживаются анемия, анизоцитоз и полихроматофилия эритроцитов (наличие фрагментированных форм), присутствие свободного гемоглобина, снижение количества тромбоцитов, лейкоцитоз, умеренная непрямая гипербилирубинемия, возрастание уровня мочевины и креатинина, гипонатриемия, гиперкалиемия, ацидоз (в олигоанурической стадии ОПН), гипоальбуминемия.
Моча приобретает коричневато-ржавый цвет, в ней могут появиться фибриновые комки, отмечается гематурия, протеинурия, гемоглобинурия. У детей с ОКИ выполняют бактериологическое исследование кала на выявление штаммов энтеропатогенной Е. coli. При тяжелых неврологических нарушениях возможно проведение КТ головного мозга и люмбальной пункции для исключения кровотечения и менингита.
Дифференциальная диагностика гемолитико-уремического синдрома проводится с неотложными хирургическими состояниями (аппендицитом, кишечной непроходимостью, окклюзией мезентериальных сосудов, перфорацией кишечника, дивертикулом подвздошной кишки), ишемическим колитом, септицемией с ДВС-синдромом, вирусным или бактериальным гастроэнтеритом, тяжелой степенью дегидратации при кишечных токсикозах, тромботической тромбоцитопенией.
Лечение гемолитико-уремического синдрома
Лечение гемолитико-уремического синдрома определяется периодом развития заболевания и тяжестью поражения почечной ткани. Чем раньше ребенок с гемолитико-уремическим синдромом поступает в стационар, тем выше вероятность его успешного и полного излечения. Патогенетическая терапия включает нормализацию агрегатного состояния крови с использованием антиагрегантов, гепаринотерапии; улучшение микроциркуляции (трентал, эуфиллин); коррекцию антиоксидантного статуса (витамины А и Е).
При бактериальной этиологии гемолитико-уремического синдрома назначаются антибиотики широкого спектра действия; при инфекции, вызванной энтеропатогенной Е. coli, прием антибиотиков и препаратов, замедляющих моторику кишечника, не рекомендуется. При олигоанурии показана коррекция водно-электролитных расстройств, подавление реакций метаболического распада и инфекционного процесса. Для коррекции тяжелой анемии используется инфузия эритроцитарной массы.
В половине случаев типичного гемолитико-уремического синдрома необходимо раннее проведение заместительной терапии: обменного плазмафереза, перитонеального диализа или гемодиализа. Гемодиализ проводится ежедневно в течение всего олигоуремического периода. В случае развития терминальной стадии ХПН показана трансплантация почки.
Прогноз
Гемолитико-уремический синдром имеет серьезный прогноз, летальность у маленьких детей во время острой фазы заболевания составляет 3-5%, у 12% развивается терминальная ХПН, у 25% происходит снижение клубочковой фильтрации. Плохой прогноз имеют атипичные наследственные, аутоиммунные и связанные с беременностью формы гемолитико-уремического синдрома.
Классическая форма гемолитико-уремического синдрома у детей раннего возраста с преимущественным поражением почечных клубочков протекает более благоприятно. В случае Д+ гемолитико-уремического синдрома наблюдается лучший исход по сравнению с недиарейным синдромом, сопровождающимся частыми рецидивами и высокой летальностью.
Публикации в СМИ
Гемолитико–уремический синдром (ГУС) — тромботическая микроангиопатия, протекающая с гемолитической анемией, тромбоцитопенией и ОПН.
Этиология • Инфекции — инфекционный ГУС (E. coli, Shigella dysenteriae, серовар I), ассоциированный с диареей (ГУС-Д+) è íå ассоциированный с диареей (ГУС-Д–)• Беременность, послеродовый период • Приём ЛС •• противозачаточные средства •• митомицин •• циклоспорин •• винбластин •• цисплатин • ГУС при злокачественной артериальной гипертензии, злокачественных новообразованиях, СКВ, системной склеродермии • Èäèîïàòè÷åñêèé ÃÓÑ.
Патогенез • Цитотоксический эффект в отношении почечного эндотелия и эритроцитов (в случае инфекционного ГУС — воздействие эндотоксинемии) приводит к отложению тромбоцитов и фибрина в сосудах почек с развитием ОПН, гемолизу эритроцитов • Усиление перикисного окисления липидов клеточных мембран свободными кислородными радикалами.
Патоморфология • Тромботическая окклюзия артериол, реже капилляров и артерий почек (кортикальный некроз, гломерулярная микроангиопатия с изменением мезангия, артериальная микроангиопатия без изменения мезангия) • Отложения IgM, С3 и С1, редко IgG и IgA без признаков васкулита.
Клиническая картина. Характерна триада: • микроангиопатическая гемолитическая анемия с ретикулоцитозом и отрицательной реакцией Кумбса; • тромбоцитопения с геморрагическим синдромом и гематурией; • олигурическая ОПН.
Возможны неврологические расстройства, лихорадка, диарея, артериальная гипертензия с сердечной недостаточностью, дыхательная недостаточность, кожная геморрагическая пурпура, кровотечения, гепато- и спленомегалия.
Лечение симптоматическое: ликвидация ОПН, коррекция электролитного и водного дисбаланса, гематологических нарушений (переливание эритроцитарной и тромбоцитарной массы), артериальной гипертензии (ингибиторы АПФ), восстановление ОЦК криссталлоидными р-рами, гемодиализ, обменные переливания свежезамороженной плазмы, плазмаферез. Преднизолон, цитостатики, антиагреганты, спленэктомия — по показаниям.
Прогноз • При эпидемическом ГУС-Д + у детей — благоприятный, возможны спонтанные ремиссии • При атипичном ГУС-Д – у взрослых — менее благоприятный. Факторы риска плохого прогноза: пожилой и старческий возраст, повышение концентрации сывороточного креатинина.
Синонимы: болезнь Гассера, синдром Гассера, болезнь Гассера–Каррера.
Сокращение. ГУС — гемолитико-уремический синдром.
МКБ-10 • D59.3 Гемолитико-уремический синдром
Код вставки на сайт
Синдром гемолитико-уремический
Гемолитико–уремический синдром (ГУС) — тромботическая микроангиопатия, протекающая с гемолитической анемией, тромбоцитопенией и ОПН.
Этиология • Инфекции — инфекционный ГУС (E. coli, Shigella dysenteriae, серовар I), ассоциированный с диареей (ГУС-Д+) è íå ассоциированный с диареей (ГУС-Д–)• Беременность, послеродовый период • Приём ЛС •• противозачаточные средства •• митомицин •• циклоспорин •• винбластин •• цисплатин • ГУС при злокачественной артериальной гипертензии, злокачественных новообразованиях, СКВ, системной склеродермии • Èäèîïàòè÷åñêèé ÃÓÑ.
Патогенез • Цитотоксический эффект в отношении почечного эндотелия и эритроцитов (в случае инфекционного ГУС — воздействие эндотоксинемии) приводит к отложению тромбоцитов и фибрина в сосудах почек с развитием ОПН, гемолизу эритроцитов • Усиление перикисного окисления липидов клеточных мембран свободными кислородными радикалами.
Патоморфология • Тромботическая окклюзия артериол, реже капилляров и артерий почек (кортикальный некроз, гломерулярная микроангиопатия с изменением мезангия, артериальная микроангиопатия без изменения мезангия) • Отложения IgM, С3 и С1, редко IgG и IgA без признаков васкулита.
Клиническая картина. Характерна триада: • микроангиопатическая гемолитическая анемия с ретикулоцитозом и отрицательной реакцией Кумбса; • тромбоцитопения с геморрагическим синдромом и гематурией; • олигурическая ОПН.
Возможны неврологические расстройства, лихорадка, диарея, артериальная гипертензия с сердечной недостаточностью, дыхательная недостаточность, кожная геморрагическая пурпура, кровотечения, гепато- и спленомегалия.
Лечение симптоматическое: ликвидация ОПН, коррекция электролитного и водного дисбаланса, гематологических нарушений (переливание эритроцитарной и тромбоцитарной массы), артериальной гипертензии (ингибиторы АПФ), восстановление ОЦК криссталлоидными р-рами, гемодиализ, обменные переливания свежезамороженной плазмы, плазмаферез. Преднизолон, цитостатики, антиагреганты, спленэктомия — по показаниям.
Прогноз • При эпидемическом ГУС-Д + у детей — благоприятный, возможны спонтанные ремиссии • При атипичном ГУС-Д – у взрослых — менее благоприятный. Факторы риска плохого прогноза: пожилой и старческий возраст, повышение концентрации сывороточного креатинина.
Синонимы: болезнь Гассера, синдром Гассера, болезнь Гассера–Каррера.
Гемолитико-уремический синдром. Болезнь Гассера
Гемолитико-уремический синдром (ГУС) назван по имени известного швейцарского педиатра Конрада Йозефа Гассера, который в 1949-55 гг исследовал и с соавторами описал это специфическое опасное состояние. Синдром Гассера включает почечную недостаточность, кровоточивость мелких сосудов из-за недостаточного содержания тромбоцитов и гемолитическую анемию, что в совокупности требует интенсивного своевременного вмешательства.
Гемолиз означает распад эритроцитов; уремия – присутствие в крови токсичных продуктов метаболизма (мочевина и др.), которые при нормальной работе почек должны из организма выводиться.
Синдром Гассера может развиваться в различных клинических формах. Некоторые из них встречаются у взрослых, но преимущественную долю заболевающих составляют дети в возрасте от 6 мес до 4 лет (ежегодная частота встречаемости 2-3 случая на 100 000 детей).
2. Причины
Спектр причин, обусловливающих и провоцирующих развитие гемолитико-уремического синдрома, объединяет две большие группы факторов – инфекционные и неинфекционные. К наиболее распространенным инфекционным факторам ГУС относятся: из бактериальных культур – кишечная палочка (три четверти всех случаев), шигелла, стрептококки, сальмонелла, анаэробные клостридии; из вирусных – ВИЧ, вирус Коксаки, энтеровирусы, вирус ветряной оспы и т.д. В раннем детском возрасте пусковым фактором в 90% случаев становится диарея (оставшиеся 10% приходятся на респираторные инфекции).
У независимого от возраста синдрома D- ГУС (атипичный синдром Гассера, не связанный с диареей, – в отличие от типичного D+ ГУС) этиопатогенетические механизмы весьма отличны: в атипичном варианте причинами становятся прием медикаментов (лекарственный ГУС), беременность, онкопроцессы, системные аутоиммунные заболевания, трансплантация, артериальная гипертензия. Во многих источниках предлагается называть «детский» ГУС болезнью Гассера, а «возраст-независимый» ГУС – синдромом Гассера, тем самым разделяя эти состояния по этиопатогенетическому принципу.
Помимо сказанного, описаны также наследственный и идиопатический (этиологически неясный) гемолитико-уремические синдромы.
3. Симптомы и диагностика
В типичном случае (D+ ГУС) в продромальном периоде заболевания имеет место профузный понос с примесями крови. Затем, в течение 1-2 недель, развивается сложный симптомокомплекс, включающий клинические признаки гемолитической анемии и почечной недостаточности: общее недомогание, бледность, вялость, слабость, редкое мочеиспускание, повышение АД, иногда желтизна склер, точечные внутрикожные кровоизлияния (петехии). В наиболее тяжелых случаях присоединяется симптоматика поражения центральной нервной системы (вплоть до судорожных припадков и комы) и желудочно-кишечного тракта. Прогностически неблагоприятными признаками являются лихорадочное состояние и анурия, т.е. полное отсутствие мочеиспускания, что создает показания к гемодиализу.
Диагноз устанавливается путем тщательного сопоставления анамнеза, динамики состояния и наблюдаемой клинической картины. Решающее значение имеет развернутое лабораторное исследование крови и мочи. В типичных случаях необходим также анализ кала – для выявления и идентификации инфекционного патогена. Из инструментальных методов наиболее информативным в данном случае является УЗИ почек, в т.ч. допплерографическое УЗ-исследование почечных сосудов.
4. Лечение
Первоочередной терапевтической задачей является нормализация биохимических и реологических характеристик крови; с этой целью назначаются антиагреганты, витаминные комплексы. При доказанной инфекционной этиологии применяют соответствующие антибиотики. Принимаются меры по нормализации водно-солевого баланса, стимуляции деятельности почек; в случаях выраженной анемии прибегают к заместительным переливаниям эритроцитарной массы, при острой почечной недостаточности назначают гемодиализ. Необходим ежедневный лабораторный контроль состава крови.
Следует отметить, что практикуемые сегодня подходы и терапевтические стратегии являются, по сути, спорными и интуитивными: их эффективность обсуждается и подвергается сомнению. Так или иначе, в большинстве случаев удается восстановить нормальную активность почек и кроветворной системы; однако и процент летальности остается достаточно высоким (до 15%, в странах третьего мира до 70%). В случаях генетически обусловленного гемолитико-уремического синдрома смертность достигает 90%, при рецидивирующем ГУС – 30%. Непосредственной причиной смерти становится, как правило, полиорганная недостаточность, токсическое поражение центральной нервной системы, нарушения сердечной деятельности. Атипичный синдром (D- ГУС) прогностически менее благоприятен, чем типичный диарейный D+ ГУС.
Заболевания 
Жалобы и симптомы 
- Боль в области почек, поясницы
- Кровь в моче (Гематурия) или помутнение мочи
- Частое мочеиспускание или его отсутствие
- Высокая температура
- Повышенное артериальное давление
- Отеки лица, ног, особенно по утрам
- Частая жажда, сухость во рту
- Общее недомогание, потеря аппетита
Если вы обнаружили у себя подобные симптомы, возможно, это сигнал заболевания, поэтому рекомендуем проконсультироваться с нашим специалистом.
Диагностика 
- УЗИ почек
- УЗИ надпочечников
- Оценка почечного кровотока
- Анализ крови на мочевину и креатинин
Наши цены 
- Консультация врача нефролога, профессор – 10000 р.
- Биохимический анализ крови (стандартная, 10 показателей) – 2470 р.
- Биохимический анализ крови (расширенаяая, 14 показателей) – 3565 р.
- Общий анализ крови – 675 р.
- УЗИ почек и оценка почечного кровотока – 1900 р.
Мы стараемся оперативно обновлять данные по ценам, но, во избежание недоразумений, просьба уточнять цены в клинике.
Данный прайс-лист не является офертой. Медицинские услуги предоставляются на основании договора.
Атипичный гемолитико-уремический синдром (аГУС)

Атипичный гемолитико-уремический синдром (аГУС) – это чрезвычайно редкое (орфанное) заболевание, связанное с недостаточностью альтернативного пути активации комплемента. По системе МКБ-10 кодируется, как D 59.3
Атипичный гемолитико-уремический синдром (аГУС). Прогноз. Причины.
К сожалению, прогноз заболевания, чаще всего, неблагоприятный. Атипичный гемолитико-уремический синдром (аГУС) – это угрожающая жизни хроническая болезнь, характеризующаяся мультисистемным поражением органов и тканей. Заболевание примерно одинаково встречается как у детей, так и у взрослых. В основе заболевания лежит тромботическая микроангиопатия (TMA), при которой в маленьких кровеносных сосудах возникают тромбы. Из-за этого нарушается кровоснабжение, и органы страдают.
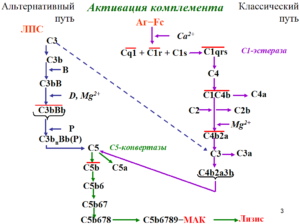
Причина болезни – сбой в системе комплемента, его очень активная деятельность вместо того, чтобы защищать организм, начинает его разрушать. Контролируют уровень активность особые белки, при атипичным гемолитико-уремический синдроме (аГУС) их функция значительно нарушена, и процесс выходит из под контроля.
Чем дольше длится токсическое агрессивное воздействие на организм, тем более пагубными становятся последствия: отказывают почки, развивается инсульт или инфаркт.
Соответственно, при ранней диагностике, при выявлении заболевания на начальных стадиях, можно снизить пагубное воздействие атипичного гемолитико-уремического синдрома (аГУС), и тем самым дать шанс человеку на нормальную полноценную жизнь.
Атипичный гемолитико-уремический синдром (аГУС). Наследование.
Атипичный гемолитико-уремический синдром (аГУС) считается наследственным заболеванием только в 20% случаев, с аутосомно-рецессивным или доминантным типом передачи. Примерно в половине случаев выявить генетическую мутацию не получается. Поэтому ДНК – анализ при атипичном гемолитико-уремическом синдроме (аГУС) не является важнейшим диагностическим методом, на его основании не может даваться заключение о начале или отмене терапии.
Атипичный гемолитико-уремический синдром (аГУС) одинаково распространен по всей планете, не выявлено зависимости от пола или расы пациентов. Из-за редкости заболевания сложно говорить о точном количестве пациентов, есть предположения о том, что болезнь встречается примерно от 1 до 9 случаев на миллион человек.
Атипичный гемолитико-уремический синдром (аГУС). Клинические проявления.
Симптомы атипичного гемолитико-уремического синдрома (аГУС) встречаются как все вместе, так и по отдельности. Насторожить должно любое из клинических проявлений болезни.

Итак, симптомами атипичного гемолитико-уремического синдрома (аГУС) являются:
- Постоянная усталость и недомогание;
- Поражение почек вплоть до необходимости гемодиализа из-за терминальной почечной недостаточности;
- Отеки, тяжесть в ногах;
- Снижение диуреза;
- Повышение креатинина крови;
- Снижение скорости клубочковой фильтрации;
- Артериальная гипертензия;
- Внепочечный тромбоз;
- Протеинурия;
- Энцефалопатия;
- Спутанность сознания;
- Судороги;
- Инсульт;
- Инфаркт;
- Кардиомиопатия с развитием сердечной недостаточности;
- Высокое артериальное давление;
- Поражение глазных сосудов;
- Поражение легких;
- Поражение кожи. Сыпь;
- Боли в животе;
- Диарея;
- Рвота;
- Колит;
- Панкреатит.

Вызывать проявления атипичного гемолитико-уремического синдрома (аГУС) могут несколько причин, зачастую они становятся спусковым крючком для начала заболевания. Вот они:
- Диарея;
- Гастроэнтерит;
- Инфекции верхних дыхательных путей;
- Беременность и роды;
- Гломерулопатия;
- Склеродермия;
- Системная красная волчанка;
- Злокачественная артериальная гипертензия;
- Злокачественные новообразования;
- Трансплантация почки и костного мозга.
Все они усиливают нарушение в системе комплемента. Иногда для манифестации заболевания бывает достаточно одного фактора, но они могут действовать и в совокупности.
Атипичный гемолитико-уремический синдром (аГУС). Диагностика.
Тромботическая микроангиопатия (TMA) – результат атипичного гемолитико-уремического синдрома (аГУС), но вызвать такое тяжелое последствие может не только аГУС, но и другие заболевания. Поэтому так важно проводить дифференциальную диагностику, чтобы квалифицировать именно манифестицию атипичного гемолитико-уремического синдрома (аГУС).
Во-первых, атипичный гемолитико-уремический синдром (аГУС) не имеет в самом начале возникновения заболевания проявлений гемоколита, во-вторых диарея может сама по себе вызвать заболевание, а не быть его симптомом. На этом этапе нужно исключить STEC и Streptococcus pneumoniae – инфекции.
Дальше методом исключения проверяем пациента на системную красную волчанку, СПИД, злокачественную гипертонию, тромботическую тромбоцитопеническую пурпуру, HELLP – синдром у рожающих женщин и ряд других заболеваний.
Напоминаем, что генетический анализ не имеет 100% достоверности, у части пациентов с подтвержденным атипичным гемолитико-уремическим синдромом (аГУС), нарушения в соответствующем гене не выявлены.
Атипичный гемолитико-уремический синдром (аГУС). Лечение.
Лечение инфузиями плазмы, пламообменом. В настоящий момент метод считается недостаточно эффективным, у одних пациентов он вызывает незначительное улучшение показателей, а у других оказывается практически бесполезным.
Гемодиализ. Процедура искусственной очистки организма лишь устраняет последствия сбоя в системе комплемента, но при этом никак не влияет на процесс избыточного образования белка. Она способна на несколько лет увеличить продолжительность жизни пациента. Сохраняется возможность развития внепочечной тромботической микроангиопатии.
Трансплантация. Почка, потерявшая свою функцию, может быть заменена на новую, но прогрессирующее заболевание может вновь начать разрушать органы и ткани. 90% пациентов опять чувствуют симптомы атипичного гемолитико-уремического синдрома (аГУС). Есть большой риск рецидива после трансплантации. Иногда можно осуществить двойную трансплантацию, и печени, и почки, но при этом возникает огромная сложность в поиске идеально подходящих двух донорских органов. Кроме того, и такая сложнейшая манипуляция может не дать гарантированного положительного результата. Тромботическая микроангиопатия развивается и в других органах.
Экулизумаб. Единственный препарат, который воздействует на механизм развития заболевания, а не на последствия болезни. Экулизумаб связывает компонент комплемента и тем самым предотвращает накопление негативных факторов. Препарат зарегистрирован в России и доказал свою эффективность. Люди с атипичным гемолитико-уремическим синдромом (аГУС) не чувствуют постоянную усталость, у них не развивается поражение органов и тканей. Внедрение в лечебную практику экулизумаба, гуманизированного моноклонального антитела к С5 – фракции терминальной стадии каскада комплемента, значительно увеличивает продолжительность жизни пациентов, а сама жизнь становится полноценной.





