Сравнительная оценка влияния дальней длинноволновой ультрафиолетовой терапии и PUVA-терапии на цитокиновый профиль больных псориазом.
Изучены лабораторные критерии эффективности использования метода дальней длинноволновой ультрафиолетовой терапии (UVA-1) в комплексном лечении больных псориазом. Под наблюдением находились 70 больных со среднетяжелыми и тяжелыми формами псориаза в фазе прогрессирования дерматоза. Для лабораторной оценки использовали ряд показателей цитокинового профиля, в частности IL-1β; γ-INF;IL-17;IL-10. В результате проведения фототерапевтических процедур статистически достоверных различий влияния данных методов терапии псориаза на показатели цитокинового профиля пациентов получено не было.
Ключевые слова: псориаз, UVA-терапия, PUVA-терапия, цитокины.
Y.A. RASSKAZOV, N. N. KONDRATYEVA, A.L. BAKULEV
Saratov State Medical University named after V.I. Razumovsky
Comparative evaluation of the effect of long-wavelength ultraviolet therapy and PUVA-therapy on the cytokine profile of patients with psoriasis
Laboratory criteria of the efficacy of the use of the method long wavelength ultraviolet therapy
(UVA-1) in treatment of patients with psoriasis were studied. We observed 70 patients with moderate to severe psoriasis in a phase progression of dermatosis. For laboratory evaluation of a number of indicators the cytokine profile is used, in particular they are: IL-1β; γ-INF; IL-17; IL-10. As a result of phototherapy treatments of statistically significant differences in the impact of these therapies on psoriasis indicators cytokine profile of patients had not been received.
Key words: psoriasis, UVA-therapy, PUVA-therapy, cytokines.
Псориаз — системное иммуноассоциированное заболевание мультифакториальной природы с доминирующим значением генетических факторов, характеризующееся ускоренной пролиферацией кератиноцитов нарушением их дифференцировки, иммунными реакциями в дерме и синовиальных оболочках, дисбалансом между противовоспалительными и провоспалительными цитокинами, частыми изменениями опорно-двигательного аппарата и внутренних органов [1, 2, 3]. В настоящее время псориаз по-прежнему остается одной из наиболее сложных проблем современной дерматологии — болеют 2—4% (130 млн человек) всего населения планеты, а удельный вес его в структуре всех заболеваний кожи составляет до 30% [5]. Современные исследователи отмечают рост заболеваемости этим дерматозом, увеличение числа тяжелых, торпидных к терапии, инвалидизирующих форм. В большинстве случаев, не угрожая жизни пациентов, дерматоз значительно ухудшает качество жизни, снижает работоспособность и социальную активность пациентов, являясь причиной социально-психологических проблем, поводом для социальной дезадаптации и самоизоляции, изменения социально-психологического комфорта, что определяет не только медицинскую, но и социальную значимость проблемы [3, 4].
Изучение иммунопатогенеза псориаза в настоящее время не представляется возможным без исследования системы регуляторных полипептидов — цитокинов. В развитии иммунного ответа дифференцировка и баланс про- и противовоспалительных цитокинов имеют ключевое значение как регуляторов активации или подавления иммунопатологических процессов в организме больных [6]. В связи с этим определение особенностей баланса системы цитокинов у больных псориазом может стать одним из направлений, позволяющих не только судить о иммунологических нарушениях, но и в последствии совершенствовать и индивидуализировать методы лечения дерматоза, а, возможно, и выявлять изменения на молекулярном, еще функционально компенсированном уровне формирующейся патологии [7].
Методика применения дальней длинноволновой УФ-терапии предложена в начале 90-х годов ХХ, когда R. Mang и J. Krutmann первыми применили ультрафиолетовое излучение УФА-1-диапазона (длина волны 340—400 нм) и показали эффективность данного метода [4, 8, 9]. По сравнению с общим диапазоном УФА (320—400 нм), УФА-1-излучение более глубоко проникает в кожу. В отличие от ПУВА-терапии, УФА-1 не требует использования фотосенсибилизаторов, обладает меньшим количеством побочных эффектов, таких как: тошнота, рвота, жжение, зуд, эритема, буллезные высыпания. В доступных литературных источниках сведений о применении дальней длинноволновой ультрафиолетовой терапии у больных псориазом нет.
Целью исследования явилась оценка эффективности терапии больных среднетяжелым и тяжелым псориазом с использованием дальней длинноволновой УФА-1-терапии.
Материал и методы
Проведено лечение 70 больных псориазом, из них мужчин 45 (64,3%) и женщин — 25 (35,7%). Основную группу исследуемых, получавших дальнюю длинноволновую ультрафиолетовую терапию, составили 40 человек, страдавших среднетяжелыми и тяжелыми формами псориаза, в возрасте 18—60 лет, без наличия тяжелой соматической или инфекционной патологии. В качестве группы сравнения наблюдали 30 человек, больных псориазом, получавших традиционную терапию в сочетании с PUVA-терапией, сопоставимых с основной группой по возрасту, длительности и форме заболевания. Все пациенты находились в стадии прогрессирования псориатического процесса. Контрольную группу составили 30 здоровых лиц.
Дальнюю длинноволновую ультрафиолетовую терапию (UVA-1) проводили с использованием фотокабины WaldmannUV-7001K (HerbertWaldmannGmbH&Co, Germany) и ламп F85/100W-TL10R, создающих излучение UVA-1-спектра (ƛ=340—400 нм) и максимумом эмиссии на ƛ=370 нм. Процедуры проводились 5 раз в неделю, начиная с дозы 5 Дж/см², происходило последовательное ее повышение на 1—2 Дж/см² до достижения максимальной разовой дозы облучения 12 Дж/см², при этом курсовая доза не превышала 156 Дж/см².
PUVA-терапия проводилась в универсальной ультрафиолетовой кабине Waldmann UV 7002K (Германия, 2010). Процедуры проводили по методике 4-разового облучения в неделю с постепенным увеличением дозы УФА на 0,5 Дж/см 2 с системным (пероральным) применением фотосенсибилизатора оксоралена (ГеротФормацойтика Гмбх, Австрия, рег. № ЛС-00114205 от 19.01.2006). Начальная доза ультрафиолетового излучения составляла 0,1—0,5 Дж/см² с последующим повышением дозы на 0,25—0,5 Дж/см² до достижения максимальной дозы облучения 7,5 Дж/см².
Для оценки содержания изучаемых цитокинов — ИЛ-1β, ИЛ-10, ИЛ-17 и γ-ИНФ в сыворотке крови применяли метод твердофазного иммуноферментного анализа.
Для исследования использовали готовые диагностические наборы «ИФА-БЕСТ».
Статистическая обработка полученных данных проводилась с помощью пакета прикладных программ «Med_Stat©» (версия 8.0) для IBMPC-совместимых компьютеров.
Использовали параметрические (общепринятый t-критерий Стьюдента; коэффициент парной корреляции между различными показателями; парный t-критерий) и непараметрические (коэффициент ранговой корреляции Спирмэна) математические критерии.
Для графического отображения результатов применяли программу «MicrosoftExcelXP™».
Результаты и их обсуждение
Проведенные исследования выявили наличие выраженных изменений концентрации про- и противовоспалительных цитокинов, а также позволили продемонстрировать участие измененного цитокинового профиля в развитии и поддержании иммунологических нарушений при псориазе. Были установлены прямые корреляции характера течения дерматоза сообразно колебаниям уровня исследуемых показателей цитокинового каскада в организме больных псориазом. Данные, свидетельствующие об уровне содержания исследуемых цитокинов до проведения фотолеченияв крови пациентов в зависимости от клинической формы псориаза, представлены в таблице 1.
Абсолютные концентрации исследуемых цитокинов в периферической крови, пациентов-участников исследования, пкг/мл
| Обследованные лица | n | IL-10, M±m | IL-1β, M±m | IL-17, M±m | γ-INF, M±m | p |
| Здоровые доноры | 30 | 2,25±0,24 | 5,55±0,31 | 2,46±0,2 | 12,39±0,24 | |
| Пациенты с псориазом, в том числе | 70 | 59,42±3,59 | 25,01±1.19 | 21,44±1,33 | 54,68±3,19 | |
| — вульгарным | 39 | 62,305±4,85 | 24,41±1,61 | 19,95±1,92 | 53,92±3,66 | |
| — экссудативным | 9 | 64,06±6,93 | 27,39±3,62 | 28,83±2,84 | 92,52±5,61 | |
| — себорейным | 16 | 54,81±6,84 | 27,15±2,76 | 23,95±2,05 | 43,32±5,74 | |
| — ладонно-подошвенным | 6 | 54,99±7,86 | 22,69±1,07 | 20,66±6,01 | 33,66±5,01 |
При анализе полученных в ходе исследования данных обращает внимание тот факт, что в группах пациентов с экссудативной и себорейной разновидностью псориаза абсолютные концентрации исследуемых показателей цитокинового профиля превышали значения, полученные в группах с вульгарной и ладонно-подошвенной формой. Вероятно, данное наблюдение позволяет судить о возрастании концентраций исследуемых цитокинов соответственно с утяжелением процессов гиперпролиферации и экссудации.
В результате проведенного фотолечения уровень провоспалительного цитокина — гамма- интерферона — в группах пациентов, страдающих псориазом, составил 56,08±4,88 пкг/мл, у получавших PUVA-терапию, соответственно 53,75±4,16 пкг/мл. Данные о изменении содержания гамма-интерферона в сыворотке крови пациентов, страдающих псориазом, под влиянием различных методов терапии, представлены в таблице 2.
Концентрация гамма-интерферона до и после проведения терапии, пкг/мл
Примечания: в числителе указаны показатели до лечения, в знаменателе — после лечения;
p1 — достоверность различий показателей до и после лечения;
p2 — достоверность различий показателей после лечения у обеих групп
В результате проведенного лечения, в каждой из групп было установлено статистически достоверное снижение уровня (р<0,05).
С помощью t-критерия Стьюдента мы установили, что разница в снижении концентрации сывороточного гамма-интерферона в периферической крови пациентов-участников исследования, получивших PUVA-терапию и UVA-1-терапию, незначительна (р<0,05).
Полученные данные свидетельствуют об отчетливом позитивном влиянии дальней длинноволновой ультрафиолетовой терапии на динамику содержания гамма-интерферона в периферической крови больных псориазом, количественно сравнимым по данному показателю с эффективностью широко используемой в настоящее время фотохимиотерапией с внутренним применением фотосенсибилизирующих препаратов.
После проведения лечения пациентов методами PUVA и UVA-1 зафиксировано статистически достоверное снижение значений концентрации интерлейкина-1бета по сравнению с показателями до начала терапии (р<0,05).
Данные о концентрации ИЛ-1бета до и после лечения представлены в таблице 3.
Уровень концентрации ИЛ-1 бета у пациентов до и после проведения терапии, пкг/мл
Примечания: в числителе указаны показатели до лечения, в знаменателе — после лечения;
р1 — достоверность различий показателей до и после лечения;
р2 — достоверность различий показателей после лечения у обеих групп
Было установлено, что различия показателей IL-1β бета после лечения в основной и контрольной группе пациентов математически не различимы (р>0,05; t=1,003), что в свою очередь говорит о сходном, вполне сравнимом влиянии применения исследуемой и традиционной методик фототерапии псориаза на концентрацию IL-1β в сыворотке крови пациентов. Полученные результаты свидетельствуют об эффективном терапевтическом влиянии метода дальней длинноволновой ультрафиолетовой UVA-1-терапии при повышенном содержании IL-1β в периферическом кровотоке больных псориазом.
Данные об изменении концентрации IL-10 у пациентов разных терапевтических групп представлены в таблице 4. После проведенной PUVA-терапии, у пациентов в контрольной группе пациентов, уровень IL-10 значительно снизился, что статистически достоверно отличалось от концентрации данного цитокина до проведения терапии (р<0,05). В группе исследования UVA-1-терапии среднее значение концентрации IL-10 после проведенного лечения, также достоверно отличалось от первоначальных значений (р<0,05). Отметим, что математически достоверного различия в результатах, полученных после проведения UVA-1-терапии и PUVA-терапии, нами выявлено не было (р>0,05), что позволяет нам констатировать равнозначное влияние данных методов лечения на уровень IL-10 в сыворотке крови пациентов-участников исследования.
Концентрация IL-10 у больных псориазом до и после применения терапии, пкг/мл
Примечания: в числителе указаны показатели до лечения, в знаменателе — после лечения;
р1 — достоверность различий показателей до и после лечения;
р2 — достоверность различий показателей после лечения у обеих групп
Данные о динамике концентрации IL-17 в процессе проведения исследования представлены в таблице 5.
Концентрация IL-17 у больных псориазом до и после применения терапии, пкг/мл
Примечания: в числителе указаны показатели до лечения, в знаменателе — после лечения;
р1 — достоверность различий показателей до и после лечения;
р2 — достоверность различий показателей после лечения у обеих групп
Дальняя длинноволновая ультрафиолетовая UVA-1 терапия в составе комплексного лечения больных среднетяжелым и тяжелым псориазом в стадии прогрессирования кожного процесса оказывает выраженное благоприятное влияние на ряд показателей цитокинового профиля страдающих данным дерматозом лиц эквивалентное по эффективности традиционно используемой PUVA-терапии.
1. Хобейш М. М., Мошкалова И. А., Соколовский Е. В. Псориаз. Современные методы лечения // В кн. Пузырные дерматозы. Псориаз. Современные методы лечения. — СПб.: Изд-во «СОТИС», 1999. — С. 70—134.
2. Молочков В. А., Бадокин В. В. Псориаз и псориатический артрит // Товарищество научных изданий КМК. — 2007. — С. 133—145.
3. Кацамбас А. Д., Лотти Т. М. Псориаз // Европейское руководство по лечению дерматологических болезней. — 2008. — С. 392—406.
4. Авдиенко И. Н., Кубанов А. А. Эффективность дальней длинноволновой ультрафиолетовой терапии у больных атопическим дерматитом // Вестник дерматологии и венерологии. — 2009. — № 3. — С. 61—64.
5. Знаменская Л. Ф., Волнухин В.А., Яковлева С. В. и др. Современные методы терапии больных псориазом //Вестник дерматологии и венерологии. — 2011. — № 1. — С. 11—14.
6. Sobell J. M., Hallas S. J. Systemic therapies for psoriasis: understanding current and newly emerging therapies [text] // SeminCutan. Med. Surg. — 2003. — Vol. 22. — № 3. — P. 187—195.
7. Kapp A. The role of cytokines for the pathogenesis of psoriasis [text] // Hautarzt. — 1993. — Vol. 44. — № 4. — P. 201—207.
8. Beani J. C. Prescription of phototherapy in psoriasis [text] // Rev. Prat. — 2004. — Vol. 54. — № 1. — P. 143—147.
9. Dawe R. S., Cameron H., Yule S., Man I. Randomized controlled trial of narrowband ultraviolet B vs bath-psoralen plus ultraviolet A photochemotherapy for psoriasis [text] // Br. J. Dermatol. — 2003. — Vol. 148. — № 6. — P. 1094—1204.
ПУВА-терапия при псориазе: результаты лечения
Фототерапия псориаза. Системная терапия
а) Фототерапия псориаза:
• Показана в случаях обширного и распространенного заболевания (псориаз считается распространенным, если количество очагов не удается легко подсчитать сразу), а также при отсутствии реакции псориаза на местную терапию.
• Ультрафиолет В узкополосного спектра действия является более эффективным, чем широкополосный ультрафиолет В и приближается по эффективности к ПУВА-терапии (псорален плюс ультрафиолет А) для лечения псориаза у пациентов с типом кожи I-III.
• Прогностические факторы, указывающие на то, какие из типов псориаза более чувствительны к ультрафиолету В узкополоспого спектра действия, в настоящее время не определены.
• 63-80% пациентов с псориазом после курса узкополосного ультрафиолета В избавляются от бляшек, причем количество рецидивов такое же, как и после ПУВА-терапии.
• Отсутствие необходимости в применении псоралена и удобство процедуры делает узкополосный ультрафиолет В фототерапевтическим методом первого выбора с ПУВА-терапией в резерве (при отсутствии эффекта).
• В одном из исследований предварительная терапия метотрексатом (15 мг в неделю в три приема) позволила добиться разрешения псориаза за меньшее коли чес гво сеансов фототерапии, чем в случаях назначения только фототерапии.
Псориаз
б) Системная терапия псориаза:
• Когда местные препараты и фототерапия не дают результатов, следующим этапом служит применение системных и биологических препаратов.
• Эти препараты являются особенно ценными для пациентов с псориатическим артритом и кожными симптомами, причем курс лечения должен начинаться как можно раньше.
• При псориазе не следует использован, системные кортикостероидные препараты. Можно спровоцировать пустулезные обострения заболевания, и эти вспышки станут роковыми.
• Метотрексат, циклоспорин и пероральные ретиноиды могут послужить причиной врожденных дефектов, поэтому терапия этими препаратами должна сопровождаться соответствующими рекомендациями, контрацепцией и тестами.
• Метотрексат (перорально): 5-15 мг в неделю в зависимости от ответной реакции на терапию и побочных эффектов. Перед лечением следует выполнить лабораторные исследования, включающие серологические тесты на вирусный гепатит В и С, Необходимы также общий анализ крови с лейкоцитарной формулой, тесты функции печени, биохимический анализ крови, и периодически – общий анализ мочи. Для предупреждения возможных побочных эффектов метотрексата пациентам необходимо принимать фолиевую кислоту по 1 г в день. По мере того, как кумулятивная доза метотрексата приближается к 1,5 г, пациента можно перевести на другой препарат, чтобы избежать биопсии печени. Существенной разницы эффективности метотрексата и циклоспорина при лечении псориаза средней и тяжелой степени в одном из исследований выявлено не было. Во время приема метотрексата и минимум 3 месяца спустя после терапии, как мужчины, так и женщины должны использовать надежные методы контрацепции.
• Циклоспорин (перорально): 1,25 mi/кг в день при тяжелом псориазе оказывает значительно больший эффект, чем плацебо. Повышение уровня креатинина в сыворотке крови, которое потребовало вмешательства, наблюдалось в 3,4% циклов лечения циклоспорином; дозы 2,5 и 5 мг/кг в день оказались значительно эффективнее применения этритината. Циклоспорин может использоваться для продолжительной терапии пациентов с тяжелым псориазом на протяжении не более двух лет.
• Пероральные ретиноиды: ацитретин (сориатен) сильно действующий системный ретиноид, который применяется для лечения псориаза. Низкая доза ацитретина (25 мг/день) переносится лучше, при этом наблюдается меньшее количество побочных эффектов и меньше отклонений в лабораторных тестах, чем при дозировке 50 мг/день. Женщинам в детородном возрасте применения этого препарата лучше избегать.
Псориаз
в) Биологические препараты для лечения псориаза:
• Перед началом терапии следует провести кожный тест на туберкулез, поскольку биологические препараты могут реактивировать скрытый (латентный) туберкулез.
• Этанерцепт (подкожно): для взрослых дозировка составляет 50 мг два раза в неделю в течение трех месяцев, затем 50 мг еженедельно. Этот препарат особенно эффективен у пациентов с псориатическим артритом, а также с вульгарным псориазом.
• Другие биологические препараты включают алефацепт (внутримышечно или внутривенно капельно), эфализумаб (подкожно), инфликсимаб (внутривенная двух- или трехчасовая инфузия). Все указанные препараты могут быть полезны, однако при их применении повышается риск развития тяжелых инфекций5.
• Экспертной группой европейских дерматологов разработаны рекомендации по применению этанерцепта при псориазе. Пациентам рекомендуется начальная доза 50 мг два раза в неделю до достижения ремиссии (максимум 24 недели). До начала лечения должны быть исключены такие противопоказания как инфекции или злокачественные опухоли (в течение 5 лет).
• Хотя биологические препараты очень дорогие, их иногда оплачивают страховые компании, кроме того, имеются программы помощи пациентам с ограниченными ресурсами, не имеющими страховки.
г) Метотрексат по сравнению с биологическими препаратами при псориазе:
• Метотрексат – недорогое лекарственное средство с более чем 40-летней историей применения и с известным потенциалом гепатотоксичности, что требует биопсии печени после двух или трех лет лечения (1,5 г) для оценки состояния органа.
• Новые биологические препараты являются синтезированными белками с более безопасным профилем по сравнению с метотрексатом, однако они очень дороги и требуют парентерального введения. Биологические препараты обладают дополнительным преимуществом продолжительной ремиссии. Тем не менее, они не лишены побочных эффектов, некоторые из которых, хотя и редкие, остаются довольно опасными.
д) Особенности лечения отдельных форм псориаза:
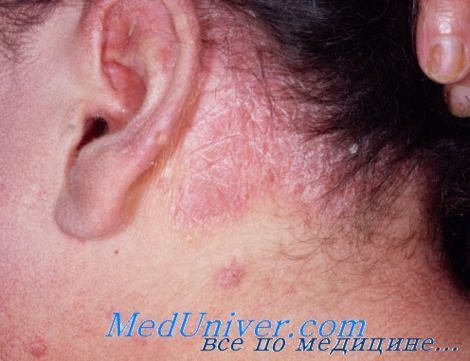
1. Особенности лечения бляшечного псориаза. Бляшечный псориаз легкой и средней степени тяжести: клобетазол два раза в день в течение двух недель. Зачем клобетазол назначается два раза в день только по выходным, а кальципотриен два раза в день в будние дни.
Тяжелая степень бляшечного псориаза: в систематизированном обзоре приведены данные 665 исследований, касающихся лечения тяжелого бляшечного псориаза. При фотохимиотерапии был достигнут самый высокий уровень клинической ремиссии (70% [6947/9925]) и значительное улучшение (83% [8238/9925]), далее следовало лечение ультрафиолетом В (67,9% [620/913]) и терапия циклоспорином (64% [ 1030/1609]). На экспертном совещании, посвященном данным анализа, была рекомендована следующая последовательность методов лечения: УФ-В, фотохимиотерапия (ПУВА), метотрексат, ацитретин и циклоспорин.
2. Особенности лечения псориаза волосистой части головы. Исследование эффективности двух препаратов на разных участках головы у одного испытуемого с псориазом волосистой части кожи головы разницы между производным витамина D и сильнодействующим стероидом не выявило. Применение генерического раствора флюоципонида при ежедневном нанесении на волосистую часть кожи головы является эффективным и доступным средством лечения. Ежедневное нанесение кальципотриена также помогает, однако этот метод более дорогой. Как увлажняющее и устраняющее чешуйки средство может использоваться минеральное масло. Шампуни с дегтем и/или салициловой кислотой помогают растворить и смыть часть чешуек.
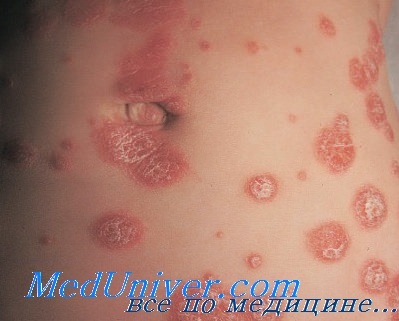
3. Особенности лечения каплевидного псориаза. Фототерапия (с дегтем или без него) или фотохимиотерапия; местные виды терапии; системное лечение при необходимости. Несмотря на то, что пациентам с каплевидным псориазом часто рекомендуются антибиотики и тонзилэктомия, убедительные доказательства пользы этих мероприятий отсутствуют.
Псориаз
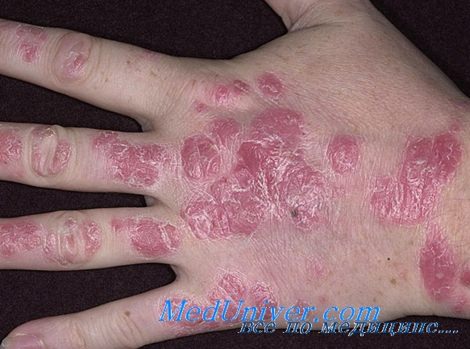
4. Особенности лечения инверсного псориаза. При инверсном псориазе могут применяться местные стероиды высокой степени фармакологической активности, несмотря на то, что изменения локализуются в складках кожи. Единственной альтернативой служит местное применение такролимуса перед сном в качестве монотерапии или в комбинации с местным сильнодействующим стероидом по утрам.
5. Особенности лечения ладнно-подошвенного псориаза. При легкой степени тяжести заболевания можно начать с местного лечения, как при бляшечном псориазе. В случаях средней и тяжелой степени заболевания может потребоваться системная терапия, например, пероральный прием ацитретина или подкожное введение эфализумаба (Раптива).
6. Особенности лечения генерализованного псориаза. Терапевтические рекомендации включают госпитализацию для постоянного контроля и устранения дегидратации, а также лечение циклоспорином, метотрексатом, пероральными ретиноидами, фототерапию или фотохимиотерапию.
7. Особенности лечения пустулезного псориаза. Применяются пероральпые ретиноиды, такие как изотретиноин или ацитретин (зависит от пола и возраста пациента), метотрексат, циклоспорин, фототерапия, при необходимости проводится госпитализация.
е) Консультирование врачом пациента. Несмотря на то, что псориаз – хроническое неизлечимое заболевание, существует множество методов его контроля. Поэтому пациенты должны постоянно наблюдаться лечащим врачом или дерматологом, чтобы контролировать свое заболевание с максимальным сохранением качества жизни.
ж) Наблюдение пациента врачом. Некоторые виды терапии требуют пристального наблюдения пациента. К ним относятся лечение цитотоксическими и биологическими препаратами и светотерапия. Если псориаз хорошо поддается контролю с помощью местных препаратов, частого наблюдения не требуется.
з) Список использованной литературы:
1. Lui Н, Mamelak A. Plaque Psoriasis. emedicine.com/derm/topic365.htm. Accessed February 1, 2007.
2. Lee MR, Cooper AJ. Immunopathogenesis of psoriasis. Australas J Dermatol. 2006;47:151-159.
3. Callen JP, Krueger GG, Lebwohl M, et al. AAD consensus statement on psoriasis therapies. J Am Acad Dermatol. 2003;49:897-899.
4. Afifi T, de GG, Huang C, Zhou Y. Topical therapies for psoriasis:Evidence-based review. Can Fam Physician. 2005;51:519-525.
5. Nast A, Kopp I, Augustin M, et al. German evidence-based guidelines for the treatment of Psoriasis vulgaris (short version). Arch Dermatol Res. 2007;299:111-138.
6. Mason J, Mason AR, Cork MJ.Topical preparations for the treatment of psoriasis: A systematic review. Br J Dermatol. 2002;146:351-364.
7. Brune A, Miller DW, Lin P, Cotrim-Russi D, Paller AS. Tacrolimus ointment is effective for psoriasis on the face and intertriginous areas in pediatric patients. Pediatr Dermatol. 2007;24:76-80.
8. Martin EG, Sanchez RM, Herrera AE, Umbert MP. Topical tacrolimus for the treatment of psoriasis on the face, genitalia, intertriginous areas and corporal plaques. I Drugs Dermatol. 2006;5:334-336.
9. Lebwohl M, Freeman AK, Chapman MS, Feldman SR, Hartle JE, Henning A.Tacrolimus ointment is effective for facial and intertriginous psoriasis. J Am Acad Dermatol. 2004;51:723-730.
10. Ibbotson SH, Bilsland D, Cox NH, et al. An update and guidance on narrowband ultraviolet В phototherapy: A British Photodermatology Group Workshop Report. Br J Dermatol. 2004;151:283-297.
11. Asawanonda P, Nateetongrungsak Y. Methotrexate plus narrowband UVB phototherapy versus narrowband UVB phototherapy alone in the treatment of plaque-type psoriasis: A randomized, placebo-controlled study. J Am Acad Dermatol. 2006;54:1013-1018.
12. Saporito FC, Menter MA. Methotrexate and psoriasis in the era of new biologic agents. J Am Acad Dermatol. 2004;50:301-309.
13. Heydendael VM, Spuls PI, Opmeer BC, et al. Methotrexate versus cyclosporine in moderate-to-severe chronic plaque psoriasis. N Engl J Med. 2003;349:658-665.
14. Faerber L, Braeutigam M.Weidinger G, et al. Cyclosporine in severe psoriasis. Results of a meta-analysis in 579 patients. Am I Clin Dermatol. 2001;2:41-47.
15. Pearce DJ, Klinger S, Ziel KK, Murad EJ, Rowell R, Feldman SR. Low-dose acitretin is associated with fewer adverse events than high-dose acitretin in the treatment of psoriasis. Arch Dermatol. 2006;142:1000-1004.
16. Boehncke WH, Brasie RA, Barker J, et al. Recommendations for the use of etanercept in psoriasis: A European dermatology expert group consensus. J Eur Acad Dermatol Venereol. 2006;20: 988-998.
17. Spuls PI, Bossuyt PM, van Everdingen JJ, Witkamp L, Bos JD.The development of practice guidelines for the treatment of severe plaque form psoriasis. Arch Dermatol. 1998;134:1591-1596.
18. Owen CM, Chalmers RJ, O’Sullivan T, Griffiths CE. A systematic review of antistreptococcal interventions for guttate and chronic plaque psoriasis. Br I Dermatol. 2001;145:886-890.
Механизмы формирования псориатической бляшки и комбинированная бальнеофотохимиотерапия больных вульгарным псориазом
Комбинированная терапия больных вульгарным псориазом с использованием ПУВА-ванн и аппликаций лечебной илово-сульфидной грязи позволяет оптимизировать лечение, ускорить процесс саногенеза, уменьшить общую лучевую нагрузку, сократить частоту нежелательных я
Mechanisms of psoriatic plaques formation and combined balneophoto-chemotherapy of psoriasis vulgaris patients
Combined therapy of patients with psoriasis vulgaris with PUVA baths and application of therapeutic silt sulfide mud to optimize treatment to accelerate the process of sanogenesis, reduce the overall radiation exposure, reduce frequency of adverse phenomena, prolong the remission.
.jpg)
Псориаз — иммунологически ассоциированное заболевание, с выраженным увеличением эпидермальной пролиферации, неполным дифференцированием эпидермоцитов, сосудистыми изменениями и наличием смешанного инфильтрата из воспалительных и иммунокомпетентных клеток в эпидермисе и сосочковом слое дермы. Иммунопатогенез псориаза представляется сложным многокомпонентным процессом взаимодействия клеточных и гуморальных компартментов иммунной системы, при этом особая роль принадлежит провоспалительным цитокинам, медиаторам, синтезируемым активированными иммуноцитами и клетками эпидермиса [1–3].
До недавнего времени считалось, что одним из наиболее важных цитокинов, занимающих ключевое место в развитии кожного и суставного процесса при псориазе, является фактор некроза опухоли альфа (ФНО-α), обеспечивающий взаимодействие клеток в рамках иммунного и воспалительного ответа, модулирующий активность иммунокомпетентных клеток дермы, индуцирующий и поддерживающий хроническое воспаление в коже и синовии. Однако дальнейшее развитие иммунологической науки и полученные фактические данные позволили установить крайне важную роль в патогенезе псориаза не только Т-хелперов первого порядка (Th1), но и Т-хелперов 17-го типа (Th17) и провоспалительных интерлейкинов 17А, 17F в формировании воспалительного компонента псориатического процесса. Установлено, что дифференциация «наивных» лимфоцитов в Th1- и Th17-клетки происходит под влиянием интерлейкинов 12 и 23, выделяемых активированными дермальными дендритными клетками. В дальнейшем происходит миграция Th1- и Th17-лимфоцитов в кожу, усиленный синтез Th1-лимфоцитами ФНО-α и гамма-интерферона, а клетками Th17 — интерлейкинов 17А, 17F, 1β, 6, 22 и других. Присутствие повышенных концентраций провоспалительных цитокинов активирует кератиноциты к синтезу собственных интерлейкинов, хемокинов и антимикробных пептидов, ускоряет пролиферацию кератиноцитов, неоангиогенез, что в целом способствует формированию псориатической бляшки [4–6]. При среднетяжелых и тяжелых формах псориаза у пациентов часто формируются крайне инфильтрированные псориатические бляшки с выраженным гиперкератозом и шелушением на поверхности, морфологическим субстратом которых является наличие высокой степени папилломатоза сосочков дермы, расширение и полнокровие мелких сосудов, склероз и утолщение коллагеновых волокон, диффузно-очаговый лимфогистиоцитарный инфильтрат с примесью гранулоцитов, очаговым экзоцитозом и формированием внутриэпидермальных скоплений нейтрофилов (микроабсцессы Мунро). Кроме того, отмечается выраженный акантоз эпидермиса и диффузный гипер- и паракератоз.
Совершенствование терапии вульгарного псориаза (ВП) остается важной медико-социальной проблемой, что связано с устойчиво высоким уровнем заболеваемости данным дерматозом в Российской Федерации и хроническим рецидивирующим течением заболевания. В последние годы отмечается учащение формирования тяжелых, инвалидизирующих форм заболевания, наблюдается торпидность течения процесса, неэффективность стандартных терапевтических подходов, фиксируется формирование ятрогенных осложнений [2, 7–9].
Среди современных эффективных методов лечения ВП ведущее место занимает фотохимиотерапия (ПУВА-терапия), основанная на сочетании ультрафиолетового облучения (УФО) в спектре 320–390 нм и действия перорально применяемого фотосенсибилизатора, который принимают однократно за 1 ч до облучения [7, 9–11]. Основной курс лечения составляет 15–20 процедур с ритмом облучения 2–4 раза в неделю, суммарное количество облучений — от 15 до 35 процедур. С увеличением экспозиции облучения в кабине от 2 до 18 минут происходит суммирование разовых доз УФО, которые достигают к моменту окончания курса значения 100–150 Дж/см 2 , что является значимой лучевой нагрузкой. В последние годы накоплены значительный опыт использования ПУВА-терапии и сведения о побочных эффектах метода: возникновение фотодерматита, гипертрихоза, хейлита, угревой болезни, кандидоза и других осложнений, в том числе развитие онкологических поражений кожи [10, 12]. Кроме того, применение фотосенсибилизаторов внутрь имеет ряд противопоказаний (выраженная дисфункция печени и почек, катаракта, афакия) и побочных реакций (диспепсические явления, гoловокружение, головная боль, сердцебиение, депрессия, гипотензия, длительная фотосенсибилизация глаз и кожи и др.), которые значительно ограничивают использование ПУВА-терапии в клинической практике [10, 12].
Разработан и используется также метод бальнеофотохимиотерапии (ПУВА-ванны), когда применение фотосенсибилизатора проводится не перорально, а наружно в виде водного раствора — при приеме ванн с растворенным в воде препаратом фотосенсибилизирующего действия [10, 13]. При данном методе лечения применялся раствор отечественного фотосенсибилизатора аммифурина 0,3%. Эффективность ПУВА-ванн в терапии больных псориазом была сравнима с таковой при пероральном приеме аммифурина, количество необходимых процедур для достижения клинического эффекта составило от 15 до 23 (медиана 19 процедур на курс) [13]. Длительность курса терапии с использованием ПУВА-ванн определялась в том числе необходимостью достижения регресса инфильтрированных псориатических бляшек на конечностях и туловище [13, 14].
В лечении больных псориазом применяется также метод пелоидотерапии (грязелечения) с использованием иловых сульфидных грязей, физико-химические особенности которых способствуют улучшению кровоснабжения кожных покровов, повышению трофики кожи, а также обладают противовоспалительным, кератолитическим действием [15–17]. Локальные аппликации иловой сульфидной грязи показаны при лечении вульгарного псориаза у взрослых и детей в возрасте от 2 лет. Описаны различные режимы пелоидотерапии, одним из которых является применение грязи, нагретой до 40–42 °С (теплогрязелечение), а также сочетание грязелечения и других физических воздействий, в том числе и УФО [18]. Одним из наиболее активных лечебных пелоидов считаются грязь Сакского озера, имеющая иловую, сульфидную природу и обладающая крайне высокой минерализацией с содержанием активных веществ более 100 г/л. В настоящее время в установленном порядке разрешены к применению одноразовые пакеты с иловой сульфидной грязью (Сертификат соответствия РОСС IL. ПК08 В 00262 от 14.04.2008), разработаны технологии по их использованию.
Впервые опыт сочетанного применения у больных псориазом метода бальнеофотохимиотерапии (ПУВА-ванны) и аппликаций иловой сульфидной грязи на область инфильтрированных бляшечных высыпаний обобщен в клинике ФГБУ УрНИИДВиИ МЗ РФ (Патент RU № 2393840 от 10 июля 2010 г.).
Материалы и методы исследования
Проведено открытое сравнительное исследование эффективности метода комбинированной терапии с использованием ПУВА-ванн и аппликаций иловой сульфидной грязи у больных ВП. В исследовании участвовали 2 группы пациентов: 26 больных вульгарным псориазом в стационарной стадии заболевания с инфильтрированными псориатическими бляшками в области туловища и конечностей, получавших комбинированное лечение (группа I); 30 пациентов с аналогичными особенностями клинических проявлений ВП, лечившихся с использованием ПУВА-ванн (группа II — сравнения). Больным обеих групп назначали наружную терапию топическими кортикосодержащими средствами умеренной степени активности.
В динамике терапии исчисляли стандартизованный индекс тяжести псориаза (индекс PASI), фиксировали регресс индекса PASI (%) после окончания терапии, суммировали общую лучевую нагрузку за весь курс терапии (доза УФА в Дж/см), при последующем клиническом наблюдении фиксировали длительность периода ремиссии (месяцы).
Противопоказаниями к использованию методов терапии являлись: непереносимость УФО и псораленов; заболевания, сопровождающиеся повышенной чувствительностью к свету; туберкулез, тиреотоксикоз, заболевания крови, печени, почек, сердечно-сосудистой системы, гипертоническая болезнь II–III степени, заболевания центральной нервной системы, диабет, беременность, период лактации, катаракта, множественные пигментные невусы, болезни крови и кроветворных органов, предраковые поражения кожи, доброкачественные и злокачественные опухоли; лечение в прошлом ионизирующим излучением, сопутствующая иммуносупрессивная терапия. Лихорадочные состояния различной этиологии; острые состояния соматических заболеваний.
Исходные демографические данные и степень тяжести псориатического процесса в обеих группах (табл. 1) достоверно не различались (р > 0,05).
Результаты и их обсуждение
Пациентам I группы был проведен курс ПУВА-ванн по следующей методике: конечная концентрация фотосенсибилизатора аммифурина в растворе 1 мг/л, температура воды 36–37 °С, продолжительность ванны 15 минут. Облучение УФА осуществлялось непосредственно после ванны. Начальную дозу облучения назначали исходя из типа кожи больного по Фитцпатрику. При этом у больных с I и II фототипом кожи облучение УФА проводили в следующем диапазоне доз: 0,5–1,0–1,5–2,0–2,5–3,0 Дж/см 2 . У больных с III и IV фототипом кожи дозы УФА повышали по следующей схеме: 0,6–1,2–1,8–2,4–3,0–3,6 Дж/см 2 . При проведении лечения ПУВА-ваннами начальная доза облучения УФА составляла для больных с I и II фототипом кожи 25–30% от минимальной фототоксической дозы (МФД), для больных с III и IV фототипом — 30–40% от МФД. Облучения проводили 3 раза в неделю.
В дни, свободные от проведения процедур ПУВА-ванн (3 раза в неделю), пациентам дополнительно назначались аппликации иловой сульфидной грязи в одноразовых пакетах. На крупные сливные очаги псориаза, характеризовавшиеся особой плотностью и выраженной инфильтрацией (как правило, в области поясницы, живота и конечностей), помещался пакет с грязью стороной, имеющей сверхтонкую, проницаемую для грязевого раствора мембрану, обеспечивающую свободное проникновение биологически активных элементов лечебной грязи к коже пациента. На пакет с грязью помещались предварительно нагретые в нагревателе термокомпрессы. Проводилось укутывание мест аппликаций лечебной грязи с сохранением температуры термокомпрессов 50–55 °C. Длительность процедуры составляла от 20 до 30 минут, всего на курс лечения проводилось 9–10 общих ПУВА-ванн и 7–9 грязевых аппликаций.
Пациентам группы II (группа сравнения) назначалась бальнеофотохимиотерапия (ПУВА-ванны) по описанной выше методике.
При проведении курса комбинированной терапии регресс симптомов заболевания начинался после первой недели лечения, когда достоверно уменьшались шелушение и гиперемия очагов, снижалась выраженность зуда кожи. В дальнейшем на 2-й и 3-й неделе лечения уменьшалась степень инфильтрации бляшек и папул, наступала их фрагментация и значительное уплощение. К моменту окончания курса лечения у большинства пациентов, получавших ПУВА-ванны и аппликации лечебной грязи, мелкие папулезные высыпания разрешались полностью, без следа; крупные псориатические бляшки оставляли после себя умеренно гиперпигментированные пятна.
В табл. 2 представлены параметры, характеризующие клиническую эффективность комбинированного способа терапии больных ВП с использованием ПУВА-ванн и аппликаций лечебной грязи в сравнении с методом лечения больных псориазом только ПУВА-ваннами.
Состояние клинической ремиссии после окончания курса было достигнуто у 73,0% пациентов, а значительное клиническое улучшение — у 27,0%. Средний показатель регресса индекса PASI по отношению к состоянию до лечения достигал 93,4 ± 2,2%.
Новый способ терапии больных псориазом ПУВА-ваннами в сочетании с аппликациями лечебной грязи позволил достигнуть более значимых клинических результатов, чем при лечении только ПУВА-ваннами: клиническая ремиссия и значительное улучшение у 100% больных против 93,4% с аналогичными исходами при общих ПУВА-ваннах.
Средний показатель достигнутого регресса тяжести проявлений псориаза (уменьшение значения индекса PASI по сравнению с исходным) при лечении комбинированным методом достоверно превышал таковой в группе пациентов, получавших только ПУВА-ванны (93,4 ± 2,2% и 81,5 ± 3,1% соответственно). При этом для достижения клинического эффекта при комбинированном лечении понадобилось в среднем 9,2 ± 1,1 ПУВА-ванн и сеансов облучения в кабине, тогда как в группе сравнения число процедур составляло в среднем 15,6 ± 1,5. Как следствие, средняя общая лучевая нагрузка за весь курс терапии при комбинированном лечении была 45,5 ± 7,3 Дж/см2, то есть на 34,3% меньше, чем при терапии общими ПУВА-ваннами. Побочные явления в виде зуда кожи и гиперемии были зафиксированы только у 2 пациентов (11,7%) из группы получавших комбинированное лечение и у 5 (16,7%) больных, получавших только ПУВА-ванны.
Последующий клинический мониторинг показал, что у пациентов с ВП, получавших ПУВА-ванны и аппликации лечебной грязи, средняя длительность клинической ремиссии составила 9,4 ± 2,3 месяца, что на 22,3% больше, чем в группе пациентов, лечившихся только ПУВА-ваннами.
Выводы
- Комбинированная терапия больных вульгарным псориазом с использованием ПУВА-ванн и аппликаций лечебной илово-сульфидной грязи оказывает антипролиферативное, иммуносупрессивное и синергичное противовоспалительное, рассасывающее действие при сочетанном воздействии двух лечебных факторов.
- Применение у больных вульгарным псориазом бальнеофотохимиотерапии и аппликаций лечебной илово-сульфидной грязи позволяет оптимизировать терапию, ускорить процесс саногенеза и уменьшить количество процедур облучений в кабине со снижением общей лучевой нагрузки, сократить частоту нежелательных побочных явлений, удлинить состояние клинической ремиссии.
- Комбинированная бальнеофотохимиотерапия больных с псориазом воспроизводима на госпитальном и амбулаторно-поликлиническом этапах оказания специализированной дерматовенерологической помощи.
Литература
- Хайрутдинов В. Р., Самцов А. В., Мошкалов А. В., Имянитов Е. Н. Современные представления об иммунных механизмах развития псориаза (обзор литературы) // Вестник дерматологии и венерологии. 2007; 1: 3–7.
- Кубанова А. А., Кубанов А. А., Николас Дж. Ф., Льюиг Л., Принц Дж., Катунина О. Р., Знаменская Л. Ф. Иммунные механизмы псориаза. Новые стратегии биологической терапии // Вестник дерматологии и венерологии 2010; 1: 35–48.
- Nickoloff B. J., Nestle F. O. Recent insights into the immunopathogenesis of psoriasis provide new therapeutic opportunities // J. Clin. Invest. 2004. Vol. 15. P. 1664–1675.
- Nast A., Kopp I., Augustin M., Banditt K. B., Boehncke W. H. et al. German evidence-based guidelines for the treatment of Psoriasis vulgaris (short version) // Arch. Dermatol. Res. 2007. Vol. 299 (3). P. 111–138.
- Nestle F. O., Kaplan D. H., Barker J. Psoriasis // NEJM. 2009; 361: 496–509.
- Johnson-Huang L. M., Lowes M. A., Krueger J. G. Putting together the psoriasis puzzle: an update on developing targeted therapies // Dis Model Mech. 2012 July; 5 (4): 423–433.
- Псориаз. Клинические рекомендации по лечению больных псориазом / Под ред. А. А. Кубановой. М.: ДЭКС-Пресс, 2008. 56 с.
- Владимиров В. В., Меньшикова Л. В. Современные представления о псориазе и методы его лечения // Русский медицинский журнал. 2001, т. 6, № 20, с. 1318–1323.
- Новоселов В. С., Новоселов А. В. Псориаз: патогенетические и клинико-терапевтические аспекты проблемы // Consilium Medicum. 2007. Т. 09.
- Волнухин В. А., Самсонов В. А., Кравцова И. В., Царегородцева Е. Е., Лукашина Т. В., Валь Е. В. Эффективность лечения больных псориазом ПУВА-ваннами // Вестник дерматологии и венерологии. 2006. № 5, с. 56–61.
- Pathirana D., Ormerod A. D., Saiag P., Smith C., Spuls P. I., Nast A., Barker J., Bos J. D. European S3-Guidelines on the systemic treatment of psoriasis vulgaris // JEADV. 2009. Vol. 23 (Suppl. 2). P. 5–70.
- Владимиров В. В. Современные методы лечения псориаза // Consilium Medicum (Дерматология). 2006, с. 23–26.
- Лечение больных псориазом методом ПУВА-ванн. Медицинская технология № ФС-2006/251 от 15 августа 2006 года // Вестник дерматологии и венерологии. 2008. № 3. С. 21–25.
- Rodriguez-Granados M. T., Carrascosa J. M., Garate Т., Gomez-Deez С., Guimaraens-Juantorena D. Consensus Document on Therapy With Bath Psoralen-UV-A // Actas Dermosifiliogr. 2007. Vol. 98. P. 164–170.
- Холопов А. П., Плохое В. В., Галциди Е. И., Катханов А. М., Шашель В. А., Тлиш М. Пелоидотерапия и фитогрязь в лечении болезней кожи и заболеваний внутренних органов у детей и взрослых. Метод. рекоменд. Краснодар, 1998. 44 с.
- Сосин И., Сосин И. Н., Буявых А. Г. Физиотерапия кожных и венерических болезней // Физиотерапия кожных и венерических болезней. Симферополь, 2001. 334 с.
- Холопов А. П., Шашель В. А., Настенко В. П.. Перов Ю. М. Сульфидная бальнеотерапия // Периодика Кубани. 2002. 150 с.
- Короткий Н. Г., Таганов А. В., Тихомиров А. А. Современная наружная терапия дерматозов (с элементами физиотерапии) / Под ред. Н. Г. Короткого. Тверь: «Губернская медицина», 2001. 528 с.
М. М. Кохан 1 , доктор медицинских наук, профессор
Ю. В. Кениксфест, доктор медицинских наук
Е. В. Гришаева, кандидат медицинских наук
А. Ю. Шефер
О. Г. Римар
Лечение псориаза ПУВА-терапией
Хронические неинфекционное заболевание дерматологического типа поддается терапии при условии комплексного подхода. Одна из эффективных методик – лечение псориаза ПУВА-терапией. Представляет собой воздействие на проблемные участки кожного покрова сочетанием ультрафиолетового излучения и фотоактивного препарата. Дает высокий процент положительных результатов.

Механизм действия
Уникальное воздействие ультрафиолетовой энергии при псориазе известно давно, но методика ПУВА используется около 40 лет. Она позволила усилить эффект, благодаря применению препаратов с фотосенсибилизирующими свойствами. Техника успешно применяется при разных поражениях кожи: дерматитах, витилиго, микозах.
Механизм действия ПУВА основан на сочетании ультрафиолета и фотоактивного препарата – псоралена (группа кислородсодержащих фурокумаринов):
- при процедуре фотосенсибилизаторы попадают в организм, где активизируются лучами ультрафиолета длинных волн;
- псорален взаимодействует с ДНК-молекулами клеток кожи;
- через полтора часа после проникновения препарата в организм происходит выборочное связывание ДНК, создаются новые перекрестные соединения;
- молекулы псоралена формируют кислородные формы, которые повреждают оболочки больных клеток;
- синтезируется арахидоновая кислота, запускающая процесс подавления синтеза кератиноцитов и лимфацитов;
- повышенная кератинизация подавляется, формируются новые, здоровые клетки;
- стимулируется синтез меланиновых пигментов.
По сути, псоралены помогают иммунной системе, подавая ей правильные сигналы и восстанавливая нормальное функционирование. Это препараты растительного или синтетического происхождения, которые после выполнения своей терапевтической работы в организме выводятся естественным путем через почки в течение 24 часов.
Установки
ПУВА-терапия применяется с помощью специальной аппаратуры. Это приборы, которые генерируют необходимое излучение. Представляют собой кабинки, оснащенные лампами люминесцентного типа, которые дают УФ-излучение с параметрами:
- длина луча: до 400 нм;
- плотность: до 13 мВт/см 2 .
Наиболее высокая сила энергетического потока достигается при длине волны в 350 – 360 нм. Такие установки бывают разного типа – для лечения в положении стоя или сидя. Также используются переносные приборы для локальной терапии кожи рук, ног, головы и так далее. Существует аппаратура, которой можно пользоваться даже в домашних условиях.

Применяемые виды лечения
В физиотерапевтической практике используется три протокола лечения ПУВА:
- системная методика – для воздействия на все тело пациента;
- локальная – для терапии отдельных зон;
- комбинированная – сочетание двух первых методик.
Фотосенсибилизирующие препараты выпускаются в разных формах – таблетки, эмульсия, крем, раствор. Применяются как для внутреннего, так и наружного лечения.
Один из эффективных способов – терапия в ванной. В воде растворяют 50 мг псоралена, пациент погружается на 15 минут, после чего проходит сеанс УФ-облучения. Такие ванны дают хороший результат как при системном, так и при локальном подходе.
Рекомендуемые параметры облучения (за одну дозу на см 2 ):
- низкий порог: 10 – 20 Дж;
- средний – 50 – 60 Дж;
- высокий – до 120 Дж.
Для получения эффекта проводится терапевтический курс из 10 – 15 процедур с выбранной дозой. Затем рекомендованы профилактические сеансы дважды в год.

Суть процедуры
Терапия проводится в специализированных условиях. Используются фотосенсибилизаторы двух типов:
- натуральные – экстракты растений;
- синтетические – аналог растительных препаратов, выведенный искусственным путем.
Согласно типу кожи подбирается псорален и его форма, процедура проводится следующим образом:
- Пациент принимает препарат или использует для обработки проблемных участков. Таблетки можно запивать молоком или пить при употреблении нежирных блюд.
- Через время (от 15 до 30 минут) проводится облучение ультрафиолетом. Начальная доза составляет 0,5 – 3 Дж на см 2 кожного покрова.
- Время воздействия УФ лучей на первом сеансе составляет несколько минут. При каждой последующей процедуры период увеличивается.
- После прохождения лечения пациент может отправляться по своим делам.
В течение 24 часов рекомендовано носить солнцезащитные очки, чтобы не допустить повреждения сетчатки глаза.

Показания
ПУВА-терапия используется при разных формах псориаза:
- простой или бляшковидный;
- каплеобразный;
- пятнистый
- пустулезный или экссудативный;
- фолликулярный;
- себорейный;
- эритродермический;
- артропатический;
- ладонно-подошвенный;
- ногтевой;
- волосистой части головы.
Также методика используется в случае низкой эффективности других способов, например, после нерезультативного приема кортикостероидных препаратов. Допустима на любой стадии псориаза, включая прогрессирующую.
Преимущества PUVA
Терапия с помощью методики ПУВА показывает высокую положительную динамику и обладает рядом достоинств:
- быстрое достижение эффекта – после двух-трех процедур состояние пораженной кожи значительно улучшается;
- комфортные условия терапии без отрыва от работы и личных дел;
- отсутствие привыкания и пролонгированный эффект;
- возможность проводить поддерживающие и профилактические сеансы без риска осложнений;
- высокий уровень переносимости лечения;
- возможность применения дополнительных методик лечения;
- длительный период ремиссии.
У всех пациентов после курса отмечается значительное улучшение состояния кожного покрова, а у около 80% людей поверхность эпидермиса очищается полностью.

Недостатки метода
Среди минусов PUVA-терапии можно отметить:
- риск появления побочных реакций;
- требуется прохождение длительного лечения;
- необходимо посещать медицинское учреждение согласно графику;
- имеются противопоказания;
- после курса необходимо обследование у офтальмолога каждый год.
При очень высокой эффективности метод не гарантирует полного излечения, а лишь обеспечивает длительный период ремиссии.
Побочные эффекты
Как пероральный, так и наружный метод использования псораленов может дать нежелательные реакции, как и облучение ультрафиолетом:
- УФ-лучи – гиперпигментация, ожоги, повреждение сетчатки глаз, фотостарение кожи;
- прием таблеток – тошнота, боли в эпигастральной области, головокружения, пониженное артериальное давление, нарушение сна;
- использование наружных средств – зуд, раздражение, сухость кожи, дерматит.
Побочные эффекты проявляются крайне редко. Чтобы избежать тошноты, таблетки нужно принимать с молочными или нежирными продуктами. Внешние негативные реакции проходят через пару дней, не представляют опасности.
Что касается риска онкологических заболеваний от облучения, многочисленные исследования не показали канцерогенного эффекта. В любом случае, при появлении любых побочных реакций следует немедленно обратиться к врачу, который скорректирует дозу лечения.
Противопоказания
Нельзя проводить PUVA-терапию в следующих случаях:
- индивидуальная непереносимость препаратов – фотосенсибилизаторов;
- период беременности и грудного вскармливания;
- заболевания, связанные с высокой чувствительностью к воздействию световых лучей;
- онкологические поражения кожи;
- серьезное поражение глазного хрусталика или его отсутствие.
В числе относительных противопоказаний – на усмотрение врача:
- пациенты со светлым фототипом кожи;
- почечная недостаточность и уремия;
- ослабленные функции иммунной системы;
- катаракта;
- поражения сердечной мышцы;
- наличие онкологических заболеваний любой локализации.
ПУВА-терапия показывает высокий и долгосрочный эффект при лечении псориаза. После первого курса наступает значительное улучшение состояния пораженной кожи. Повторные профилактические сеансы позволяют поддерживать ремиссию длительное время.
Другие статьи:

Папилломы представляют собой разрастания на коже и слизистых оболочках. Наиболее часто папилломы на интимных местах расположены на коже наружных половых органах и слизистых уретры, влагалища, шейки матки, в области вокруг анального отверстия.

Бородавки – это поражения кожи, появляющиеся в виде особых округлых образований, выступающих над поверхностью. Возникают они вследствие специфических вирусов.

Небольшой нарост телесного цвета на нижнем или верхнем веке можете свидетельствовать о наличии папилломавирусной инфекции. После подтверждения диагноза врач сообщает пациенту о доступных способах удаления папиллом на веке. Также в схему лечения входят методы профилактики появления наростов повторно.
ПУВА-терапия псориаза
Псориаз представляет собой кожное заболевание, характеризующееся появлением выступающих пятен с бело-серыми чешуйками, которые сопровождаются шелушением и зудом. Болезнь хроническая, с волнообразным течением. Высыпания могут занимать значительную площадь, доставляя психологический и физический дискомфорт. ПУВА-терапия при псориазе является одним из наиболее действенных способов лечения заболевания.
Сущность метода PUVA раскрывается в аббревиатуре, составленной от английских слов Psoralens и UltraViolet. Псорален – это фотосенсибилизатор, т. е. вещество, которое делает кожу более чувствительной к ультрафиолету при электромагнитном излучении с длинными волнами. Ультрафиолет имеет свойство оказывать противовоспалительное, антибактериальное и иммуномодулирующее действия. Псоралены усиливают его лечебный эффект.
Показания
- Бляшечный (вульгарный) – наиболее часто встречающаяся форма заболевания (85% случаев), поражающая любые части тела. При нем появляются сначала маленькие вздутые области красного цвета, которые растут и сливаются между собой. На их поверхности видны бело-серебристые бляшки, под которыми находится воспаленная кожа.
- Каплевидный – встречается в 10% случаев, диагностируется чаще у детей и взрослых до 30 лет. Характеризуется маленькими выпуклыми высыпаниями размером 1-10 мм, по своей форме напоминающими капли. Недуг в основном локализуется на бедрах, реже поражает нижнюю часть ног, спину, руки. Тяжелая форма каплевидного псориаза называется еще пятнистым.
- Пустулезный (экссудативный) – высыпания (пустулы) желтоватого цвета, окруженные красной воспаленной кожей, внутри которых находится экссудативная жидкость. Поражают подошвы ног и кисти рук. Диагностируется эта форма редко и в основном у мужчин в возрасте 20-35 лет.
Осложнением заболевания является эритродермический псориаз (1-2% случаев), способный охватывать все тело – опасное состояние, сопровождающееся болезненностью и зудом.
Противопоказания
Терапию ПУВА не проводят при:
- заболеваниях, характеризующихся гиперчувствительностью к свету (альбинизм, порфирия, красная волчанка);
- беременности;
- наличии индивидуальной непереносимости к фотосенсибилизаторам и ультрафиолету;
- отсутствии хрусталика глаза;
- меланоме (злокачественном кожном заболевании);
- наличии ожогов.
Также необходимо соблюдать ряд ограничений и осторожность, чтобы сделать ПУВА-терапию при псориазе при следующих обстоятельствах:
- болезнях глаз;
- детском возрасте;
- пожилом возрасте;
- онкологии;
- наличии очень светлой кожи;
- иммунодефиците;
- ранее проводимом радиационном облучении;
- фотогенной эпилепсии;
- почечной недостаточности;
- уремии – отравлении организма, спровоцированном нарушением работы почек.
Преимущества методики
Главными преимуществами метода ПУВА является использование при всех формах псориаза и эффективность. Фотохимиотерапия помогает полностью очистить кожу или значительно снизить площадь поражения более, чем в 80% случаев.
Среди других сильных сторон ПУВА можно выделить:
- быстрый и стойкий результат – уже после нескольких процедур происходят значительные улучшения, а после курса наступает ремиссия на длительный срок;
- может использоваться на любых стадиях заболевания;
- не требует лечения в стационаре, терапия может проводиться амбулаторно в поликлинике или медицинском центре;
- безопасность – при правильно проведенной процедуре риск негативных реакций минимальный;
- процедура не вызывает болей или дискомфорта;
- не вызывает привыкания – при повторных курсах терапевтический эффект также высок.
Описание процедуры

Процедура может проводиться несколькими способами.
При системном (общем) подходе, самом распространенном методе, задействуется все тело. Для этого за 2-3 часа до процедуры с молоком или нежирной пищей принимается фотосенсибилизирующий препарат в таблетках или капсулах.
При локальном способе воздействия на кожу наносится специальная эмульсия, которая должна полностью впитаться перед следующим этапом.
Затем проводится облучение с помощью ламп солярного типа, по продолжительности занимающее 3-20 минут. Время процедур увеличивается постепенно и зависит от степени тяжести и распространенности заболевания. Дозировка также устанавливается врачом в зависимости от типа кожи после тестового облучения небольшой области кожи. Проводятся сеансы через 2-3 дня, чтобы дать организму необходимый отдых. Количество процедур в одном курсе варьируется от 10 до 25.
Существует также метод применения ПУВА с погружением пациента в фотосенсибилизирующую ванну с растворенным в ней препаратом, после чего также происходит процесс облучения. Такой способ подходит детям и пациентам, у которых наблюдаются негативные реакции от приема препарата внутрь.
После процедуры на кожу наносятся питательные и восстанавливающие средства.
В процессе лечения и после необходимо соблюдать правила:
- одевать очки, чтобы минимизировать риск повреждения хрусталика от ультрафиолетовых лучей;
- наносить на губы, лицо и соски фотозащитные средства;
- не использовать средства на основе дегтя;
- с антибактериальным или дезодорирующим действием.
Сколько держится положительный эффект
Регресс заболевания наблюдается уже после 3-5 процедур. После проведения курса лечения в полной мере проявляется положительный эффект от фотохимиотерапии, заключающийся в наступлении ремиссии – полного устранения симптоматики псориаза или значительном улучшении состояния.
Период после лечения ПУВА длится от полугода до 1-3 лет. Продолжительность у женщин и мужчин – разная. У первых ремиссия в среднем длится год и 2 месяца, у мужчин – 11 месяцев. Различие связано с тем, что женская половина человечества ответственнее относится к здоровью и ведет более правильный образ жизни, нежели представители мужского пола.
Стоимость ПУВА-терапии высока и варьируется в зависимости от уровня медицинского учреждения, предлагающего услугу, и места проведения (в Москве и крупных городах – цена выше).
Антицитокиновая терапия псориаза
Современные средства и методы общего лечения больных псориазом включают фотохимиотерапию (ФХТ, ПУВА-терапию), метотрексат, циклоспорин А, ароматические ретиноиды, кортикостероиды.
Ни при каком другом заболевании, кроме псориаза, не было введено в медицинскую практику такого количества разнообразных средств и методов лечения. Были испробованы препараты ртути и фосфора, йода и мышьяка, серы и дегтя, салициловой и карболовой кислоты, лакто- и гемотерапия, инсулин и антиаритмические средства. Современные средства и методы общего лечения больных псориазом включают фотохимиотерапию (ФХТ, ПУВА-терапию), метотрексат, циклоспорин А, ароматические ретиноиды, кортикостероиды. ## ПУВА-терапия Первые сообщения о применении ФХТ при лечении больных псориазом появились в литературе в 1974—75 годах. Метод лечения заключается в том, что пациент принимает внутрь или втирает в очаг поражения фотосенсибилизирующий препарат (8-метоксипсорален, метоксален), а через 2—2,5 часа подвергается длинноволновому ультрафиолетовому облучению. Для достижения клинического эффекта необходимо провести от 10 до 30 процедур 2—4 раза в неделю. Высокая эффективность ПУВА-терапии (72,7—99 %) сделала этот метод лечения одним из наиболее популярных во всем мире. Однако **ФХТ не проводят** больным моложе 5 и старше 60 лет, при нарушениях функции печени и почек, диабете и тяжелых эндокринопатиях, сердечно-сосудистой патологии, новообразованиях, туберкулезе, катаракте, глаукоме, беременности и лактации. К острым осложнениям ФХТ относятся слабость, сонливость, головная боль, головокружение, рвота, боль в эпигастрии, отеки ног, зуд различной степени интенсивности, эритема, фотодерматоз, гиперпигментация. Риск развития отдаленных, более серьезных осложнений ФХТ (рак кожи, катаракта) требует соблюдения необходимых мер предосторожности и врачебного контроля. При тяжелых, распространенных, торпидно текущих формах псориаза в настоящее время применяют комбинированную терапию: ФХТ + цитостатики (кортикостероиды) или ФХТ + ароматические ретиноиды (RE-ПУВА-терапия). Назначение подобных комбинированных методов оправдывается лишь тяжестью псориатического процесса. ## Цитостатики Первое сообщение о лечении псориаза препаратом этой группы — аминоптерином — появилось в 1951 году. Самым эффективным цитостатиком в настоящее время остается метотрексат, который показан в случаях тяжелого течения псориаза (эритродермическом, артропатическом, пустулезном), при рефрактерности к другим методам лечения. **К противопоказаниям относятся** : нарушение функции почек (24-часовой клиренс креатинина менее 77 мл/мин), заболевания печени в анамнезе, нарушение функции печени до начала лечения, анемия (гемоглобин ниже 10г/100 мл), лейкопения (лейкоциты менее 4 тыс/мм3), тромбоцитопения, язвенная болезнь желудка и 12-перстной кишки в стадии обострения, алкоголизм, беременность, лактация, инфекционные заболевания (активный туберкулез, СПИД). Как правило, метотрексат назначают 1 раз в неделю внутрь в дозе 10—20 мг на один прием или 2,5—7,5 мг на три приема через 12 ч в течение суток. Внутримышечно по 25 мг не более 6—7 инъекций. Реже — курсами по 2,5 мг 3 раза в день по 5—7 дней с перерывами 3—5 дней. Лечение должен проводить врач, имеющий опыт химиотерапии антиметаболитами. Самолечение полностью исключено. Терапию проводят под контролем клинического и биохимического анализа крови и анализа мочи один раз в 10—15 дней. Положительная динамика высыпаний отмечается через 10—14 дней после начала лечения. Показаниями к отмене являются: лейкопения (лейкоциты менее 4 тыс/мм3); снижение гематокрита на 10 % и более; тромбоцитопения; АСТ, АЛТ выше 60 ед/л; задержка бромсульфалеина более чем на 10 %; снижение клиренса креатинина; диарея; язвенный стоматит, эзофагит, гастрит, колит; отсутствие клинического эффекта через 8 недель лечения. К недостаткам терапии относятся возможное извращение течения псориаза и его обострение через несколько недель после отмены препарата, иногда более тяжелое, чем предыдущее (феномен «рикошета»), а также побочные эффекты, связанные с токсико-аллергическим, цитостатическим и иммуносупрессивным действием метотрексата. Препарат несовместим с сульфаниламидами, салицилатами, антибиотиками пенициллинового ряда, ароматическими ретиноидами, антикоагулянтами. ## Циклоспорин А Способность циклоспорина А быстро и эффективно купировать обострение псориаза была случайно замечена в 1979 году. Как правило, циклоспорин А назначают в дозе 5—15 мг/кг в сутки для лечения тяжелых, распространенных, торпидно текущих форм псориаза. **Противопоказания** включают нарушения функции печени, почек; беременность и лактацию; инфекционные заболевания. К осложнениям относятся: нефротоксичность и развитие вторичного иммунодефицитного состояния, приводящее к формированию как инфекционных осложнений (особенно вирусных), так и злокачественных опухолей (рак кожи, лимфома, саркома Капоши). ## Ароматические ретиноиды Первое сообщение об успешном применении синтетического производного витамина А — этретината — было сделано в 1975 году. Сейчас в мире для лечения псориаза применяется ацитретин. Ароматические ретиноиды показаны при псориатической эритродермии и пустулезном псориазе. **К противопоказаниям относятся:** детородный возраст у женщин, беременность и лактация; нарушения функций печени и почек; гипервитаминоз А; гиперлипидемия. Ацитретин назначают обычно в дозе 25—75 мг в сутки (но не более 1 мг/кг внутрь в течение 8—10 недель). Монотерапия ароматическими ретиноидами приводит к клиническому излечению у 12 % больных, к значительному улучшению — у 41 % и улучшению — у 47 % больных. К недостаткам ацитретина относится его токсичность, проявляющаяся синдромом гипервитаминоза А (хейлит, сухость слизистых оболочек и кожи, зуд, шелушение ладоней и подошв, выпадение волос, нарушение роста ногтей, блефароконъюктивит, расстройства темновой адаптации, боли в мышцах, суставах и костях, спинальный гиперостоз, кальцификация, остеопороз, носовые кровотечения). Суточная доза ацитретина, вызывающая осложнения, равна или выше 1 мг/кг в сутки, т. е. интервал между терапевтической и токсической дозами чрезвычайно мал. Серьезным осложнением лечения является тератогенный эффект, поэтому женщине, принимающей ацитретин, нельзя беременеть не только во время, но и в течение 2 лет после окончания лечения препаратом. Терапевтический эффект ретиноидов в случае монотерапии сохраняется, как правило, в течение всего периода лечения. После отмены ацитретина рецидивы возникают довольно быстро, поэтому необходимо использовать ретиноиды в комбинации с другими методами лечения, фотохимиотерапией (Rе-ПУВА-терапия). ## Кортикостероидные препараты Кортикостероиды вошли в практику дерматологии в 1950 году. Основным показанием к их применению при псориазе являются крайне тяжелые эритодермические и артропатические формы, особенно с выраженным экссудативным компонентом. **К противопоказаниям относятся** : тяжелая сердечно-сосудстая патология; тяжелый сахарный диабет; эрозивно-язвенная патология желудочно-кишечного тракта; недавно перенесенные операции; инфекционные заболевания (туберкулез, сифилис и др.); психические заболевания; беременность, лактация; острые гнойные процессы. Наиболее часто применяется преднизолон в дозе 30—80 мг в сутки внутрь (с учетом состояния и веса больного), причем 1/3—1/2 суточной дозы — в утренние приемы. Снижение дозы вначале возможно на 1/3, затем — очень медленно до поддерживающей дозы (5—10 мг) или полной отмены препарата. Кроме преднизолона, при псориазе назначают также преднизон, метилпреднизолон, дексаметазон, триамцинолон. Препараты пролонгированного действия метилпреднизолона и бетаметазона обычно применяют внутримышечно один раз в 1—4 недели; препараты триамциналона, как правило, для внутрисуставного введения при артропатическом псориазе. Лечение проводится под контролем артериального давления, ЭКГ, клинического и биохимического анализа крови, электролитного баланса, свертываемости крови, диуреза и массы тела больного. Показаниями к отмене служит: эрозивно-язвенные осложнения со стороны желудочно-кишечного тракта; тяжелая сердечно-сосудистая патология; острый психоз; отсутствие клинического эффекта в течение 7—10 дней. Побочные действия могут включать: симптомокомплекс Иценко-Кушинга (отеки гипокалиемия, гиперкалиемия, гипертония), ожирение, стероидный диабет, геморрагический панкреатит, остеопороз, эрозивно-язвенную патологию желудочно-кишечного тракта (в т. ч. обострение язвенной болезни желудка и 12-перстной кишки), гипертонию, тромбоз и тромбоэмболию, эйфорию, психомоторное возбуждение, психоз, нарушение кроветворения (лимфопения). Кортикостероиды значительно изменяют характер течения псориатического процесса, повышая его рефрактерность. Уменьшение дозы или отмена кортикостероидов быстро ведут к рецидивам заболевания, которые нередко бывают более тяжелыми и продолжительными, чем предыдущие (феномен «рикошета»), характеризуются устойчивостью к проводимой терапии, требуют применения более высоких доз кортикостероидов. Поэтому в ряде случаев больные с тяжелым рефрактерным распространенным псориазом прибегают к сочетанному применению преднизолона и метотрексата. Например, преднизолон внутрь в дозе 80 мг в сутки и метотрексат внутримышечно 25 мг один раз в неделю. Таким образом, перечисленные эффективные средства и методы терапии псориаза не лишены серьезных недостатков, что ограничивает возможность их использования. Исследования этиологии и патогенеза псориаза для создания теоретически обоснованных, универсальных методов его лечения продолжаются. ## Моноклональные антитела к ФНО-альфа в лечении псориаза Одно из наиболее ярких достижений фармакотерапии воспалительных заболеваний человека — создание антицитокиновых препаратов (биологических модификаторов иммунного ответа, biologics response modifiers). К основным направлениям разработок в этой области относят создание моноклональных антител (мАТ) против определенных детерминант иммунокомпетентных клеток или провоспалительных цитокинов, рекомбинантных антивоспалительных цитокинов и естественных ингибиторов цитокинов (растворимых рецепторов и антагонистов рецепторов). Первые, широко внедренные в клиническую практику, мАТ к ФНО-альфа получили название инфликсимаб (Ремикейд, Schering-Plough). Препарат представляет собой химерные мАТ, состоящие из вариабельной (Fv) области высокоаффинных нейтрализующих мышиных мАТ к ФНО-альфа, соединенных с фрагментом молекулы IgG1k человека, занимающей 2/3 молекулы АТ и обеспечивающей ее эффекторные функции. Инфликсимаб связывается с ФНО-альфа с высокой специфичностью, афинностью и авидностью, образует стабильные комплексы с ФНО-альфа, подавляет биологическую активность свободного и мембран-ассоциированного ФНО-альфа, не взаимодействует с лимфотоксином (ФНО-альфа), лизирует (или индуцирует апоптоз) ФНО-продуцирующих клеток. Эффективность Ремикейда продемонстрирована при ревматоидном артрите, болезни Крона, анкилозирующем спондилите, ювенильном идиопатическом артрите, болезни Стилла у взрослых, системных васкулитах, болезни Бехчета, полимиозите, первичном синдроме Шегрена, вторичном амилоидозе. В общей сложности, по разным показаниям, в мире инфликсимаб использован для лечения около 1 млн больных. Выраженный эффект инфликсимаба при аутоиммунной патологии, ассоциированной с Th1-типом иммунного ответа, послужил основанием для изучения препарата при других заболеваниях со сходным патогенезом, в частности при псориазе и псориатическом артрите. В настоящее время в мире накоплен опыт применения мАТ к ФНО-альфа у тысячи больных псориазом Chaudhari и соавт. (2001). Первыми провели двойное слепое, плацебо-контролируемое исследование, в котором оценивалась эффективность инфликсимаба у 33 больных средне-тяжелым и тяжелым бляшечным псориазом. В случайном порядке пациентов распределяли на три группы: плацебо (n = 11), инфликсимаб 5 мг/кг (n = 11) и инфликсимаб 10 мг/кг (n = 11). Инфузии проводили исходно и через 2 и 6 недель. Результаты оценивали через 10 недель у всех больных, начавших лечение по двум критериям: общей оценки врача (PGA) и индексу PASI. В группе инфликсимаба 5 мг/кг на лечение ответили (хороший и прекрасный эффект по оценке врача) 9 (82 %) из 11 больных, в группе плацебо — 2 (10 %) из 11 (различие 64 %, 95 % доверительный интервал 20—89, р = 0,0089). В группе инфликсимаба 10 мг/кг на лечение ответили 10 (91 %) из 11 больных (различие с группой плацебо 73 %, 95 % доверительный интервал 30—94, р = 0,0019). Другим критерием в этом исследовании была динамика индекса PASI. Клинически значимым считают его снижение на 75 %, поэтому важным критерием эффективности лечения является не только среднее снижение индекса, но и процент больных, у которых он уменьшился на 75 % и более. Снижение PASI на 75 % наблюдалось у 9 (82 %) и 8 (73 %) больных, получавших инфликсимаб в дозах 5 и 10 мг/кг, и лишь 2 (18 %) больных группы плацебо. Средний индекс PASI в трех группах снизился с 22,1, 26,6 и 20,3 до 3,8, 5,9 и 17,5 соответственно (р < 0,0003). Различие между двумя группами больных, получавших активное лечение, и группой плацебо достигало статистической значимости через 2 недели (p < 0,003), а медиана времени до достижения ответа составила 4 недели в обеих группах больных, получавших инфликсимаб. Серьезных нежелательных явлений зарегистрировано не было, а переносимость инфликсимаба была хорошей. В дальнейшем убедительные результаты, свидетельствующие о высокой эффективности инфликсимаба при псориазе, были получены в процессе международного, многоцентрового рандомизированного, двойного слепого плацебо-контролируемого исследования SPIRIT, результаты которого были представлены А. Gottlieb на 12 конгрессе Европейской Ассоциации дерматовенерологов (EADV, 2003). 249 пациентов были распределены на три группы: плацебо (n = 51), инфликсимаб 3 мг/кг (n = 99) и инфликсимаб 5 мг/кг (n = 99). В исследование включали пациентов старше 18 лет, страдающих бляшечным псориазом более 6 месяцев. Предшествующее системное лечение или ПУВА-терапия у них были неэффективны, индекс PASI превышал 12. Критерии исключения: активный или латентный туберкулез, серьезные инфекционные заболевания менее чем за 2 месяца до начала лечения, лимфопролиферативные заболевания и/или злокачественные новообразования менее чем за 5 лет до начала терапии инфликсимабом. Результаты оценивали каждые 2 недели в течение 26 недель у всех больных по тем же критериям, что и Chaudhari и соавт. (2001). Инфузии проводили исходно и через 2 и 6 недель. Установлено, что положительная динамика высыпаний на фоне введения первой дозы инфликсимаба наступает очень быстро — в течение первых двух недель. Индекс PASI быстро и статистически достоверно снижается на 75 % в течение первых 4 недель (рис. 2). Инфликсимаб в дозе 5 мг/кг эффективнее, чем 3 мг/кг. Препарат хорошо переносится. Побочные эффекты аналогичны таковым при лечении ревматоидного артрита, болезни Крона и анкилозирующего спондилоартроза. Чаще всего регистрировались инфекции верхних дыхательных путей: 13,7 % в группе, получавшей плацебо, 16,3 % — инфликсимаб 3 мг/кг и 14,1 % — инфликсимаб 5 мг/кг, т. е. разница в частоте побочных эффектов была недостоверной. Авторы доказали, что лечение инфликсимабом улучшает качество жизни больного псориазом. На 12 конгрессе EADV (2003) Ch. Antoni были доложены результаты двойного слепого, рандомизированного, плацебо-контролируемого, многоцентрового исследования IMPACT (Infliximab Multinational Psoriatic Artritis Controlled Trial). Эффективность инфликсимаба в дозе 5 мг/кг оценивали у 52 больных активным псориатическим артритом. Препарат вводили исходно, через 2, 6 и 14 недель, далее — 1 раз в 8 недель в течение 102 недель (2 года). Продемонстрирована нормализация гистологической картины кожи на фоне лечения инфликсимабом, а также статистически достоверное улучшение суставного процесса по критериям ACR (Американского Колледжа Ревматологов), Clegg DO и соавт. и результатам магнитно-резонансной томографии. В отделении дерматологии ЦКБ Медицинского центра УД Президента РФ, которое является клинической базой кафедры кожных и венерических болезней факультета фундаментальной медицины МГУ им. М В. Ломоносова, инфликсимаб применяли в качестве монотерапии 23 больных псориазом (8 женщин и 15 мужчин), рефрактерных к предшествующей терапии. Возраст пациентов — от 18 до 72 лет, длительность заболевания — от 12 до 43 лет. Большинство больных (17) страдали артропатическим, 6 — распространенным вульгарным псориазом. Предшествующая терапия у всех пациентов была неэффективна: традиционное «базисное» лечение — у всех, гемосорбция — 2, прерывистый плазмаферез — 8, этретинат — 11, кортикостероидные гормоны внутрь — 3, ПУВА — 13, метотрексат — 7, циклоспорин — 8. Всем пациентам до начала лечения, до и после каждого введения Ремикейда проводили общее клиническое обследование и контроль артериального давления. Общеклинические анализы крови и мочи, биохимический анализ крови, исследование иммунного статуса, ЭКГ выполняли до начала лечения, перед каждым последующим введением препарата и через 2 недели после окончания лечения. Индекс PASI определяли 1 раз в две недели на протяжении лечения и последующего наблюдения в течение полугода. Инфликсимаб вводили в дозе 3,0 мг/кг внутривенно: исходно, через 2 и 6 недель. У всех больных уже после первой инфузии отмечался быстрый регресс высыпаний: на 3—5 сутки уменьшалось шелушение и экссудативные явления, исчезал венчик гиперемии вокруг папул и бляшек, на 8—10 сутки появлялся псевдоатрофический ободок Воронова, уменьшалась инфильтрация элементов. Клинические примеры представлены на рис. 3 и 4. Динамика индекса PASI в целом была близка к таковой в исследовании SPIRIT. Переносимость инфликсимаба в целом была хорошей. Лишь у одного больного во время каждой инфузии появлялась головная боль, самопроизвольно регрессировавшая и не связанная с изменением артериального давления. ## ИТОГ Предложено много антицитокиновых препаратов для лечения псориаза, но лишь единицы из них используются, практическое применение остальных остается делом будущего. МАТ к ФНО-альфа (инфликсимаб) доказали свою эффективность и безопасность при артропатическом и рефрактерном вульгарном псориазе. По-видимому, наиболее важный механизм действия инфликсимаба — ингибиция синтеза не только самого ФНО-альфа, но и блок каскада других медиаторов, запускаемого ФНО-альфа. ## Заключение Внедрение в клиническую практику биологических модификаторов иммунного ответа — одно из наиболее крупных достижений медицины последнего десятилетия. Инфликсимаб (Ремикейд) эффективен при псориазе, рефрактерном к любой другой терапии. По сравнению с «традиционными» базисными препаратами для системного лечения псориаза инфликсимаб: более безопасен и эффективен может длительно применяется без снижения эффективности и развития токсических реакций; требует минимального мониторинга; замедляет рентгенологическое прогрессирование суставной деструкции при артропатическом псориазе; улучшает функциональную активность и качество жизни пациента. Широкое внедрение стратегии, основанной на применении эффективной и безопасной терапии, требующей минимального мониторинга, в т. ч. с использованием биологических модификаторов иммунного ответа, является одной из наиболее важных задач дерматологии. _М И. Курдина Факультет фундаментальной медицины МГУ им. М В. Ломоносова, ЦКБ Медицинского центра УД Президента РФ, Москва_.


