Роль нарушений клеточной энергетики в развитии заболеваний сердца и возможности их метаболической терапии
В настоящее время в структуре сердечно-сосудистых заболеваний у детей увеличивается удельный вес неспецифических поражений миокарда метаболического характера, в патогенезе которых большое значение имеют нарушения энергетических процессов.
Высокая частота метаболических изменений при заболеваниях сердца объясняется особенностями обмена веществ в кардиомиоцитах и характеризуется преобладанием аэробного метаболизма, высокой скоростью энергетических процессов в миокарде, минимальным запасом макроэргических соединений, а также адренергическим контролем процессов энергообразования.
Метаболические заболевания миокарда можно классифицировать на две большие группы: кардиомиопатии (КМП) и миокардиодистрофии.
Миокардиодистрофия
Миокардиодистрофия – заболевание сердца, в основе которого лежит нарушение метаболизма в миокарде, приводящее к дистрофическим изменениям в кардиомиоцитах и проводящей системе сердца, что может привести к снижению сократительной функции сердца. Принципиальным отличием миокардиодистрофии от метаболических КМП является отсутствие грубой структурной перестройки миокарда на макроуровне. При этом метаболические изменения проявляются на ультраструктурном уровне (клеточном и субклеточном).
Согласно современным представлениям миокардиодистрофия является мультифакторным патологическим процессом, возникающим под влиянием интоксикаций, перегрузок, трофических изменений, обусловленных нарушением нервной регуляции, дисгормональных состояний. В раннем возрасте в развитии миокардиодистрофии особенно велика роль нарушений питания, ОРЗ, рахита, анемии и др. Гипокинезия современных школьников в сочетании с большими эмоциональными нагрузками ведет к частому возникновению синдрома вегетативной дисфункции. Вегетативный дисбаланс, характеризующийся гиперактивацией симпатикоадреналовой системы, приводит к повышенным энергозатратам кардиомиоцитов, вызывает нарушения микроциркуляции и электролитного обмена, способствует развитию выраженных дистрофических изменений в миокарде.
Особую форму повреждений миокарда у школьников представляет дистрофия вследствие физического перенапряжения. Известны варианты дистрофии миокарда, возникающие у спортсменов, которые продолжали выполнять упражнения в период заболеваний или в фазе реконвалесценции.
Диагностика
Основным критерием диагностики дистрофических изменений в миокарде являются нарушения процессов реполяризации на ЭКГ в виде сглаженного или отрицательного зубца Т и/или депрессии сегмента ST. Изменения процессов реполяризации могут быть как распространенными (регистрируются более чем в 3-х отведениях), так и локальными. Начальные стадии миокардиодистрофии протекают, как правило, бессимптомно, а нарушения на ЭКГ выявляются случайно при диспансеризации ребенка. Дети с миокардиодистрофией на фоне синдрома вегетативной дисфункции предъявляют жалобы на повышенную утомляемость, плохую переносимость физических нагрузок, кардиалгии. Для диагностики адренозависимых и/или калийзависимых нарушений процесса реполяризации следует использовать лекарственные пробы с калием и/или с обзиданом. Положительный результат калий обзидановой пробы (улучшение процессов реполяризации в виде появления положительных или увеличения амплитуды зубцов Т в тех отведениях, где на ЭКГ покоя были выявлены их снижение и инверсия) регистрируется у 60% детей с миокардиодистрофией и свидетельствует об адренозависимом характере ST-T-нарушений. Отрицательный вариант калий обзидановой пробы, отражающий более выраженные метаболические нарушения в сердечной мышце, регистрируется в 40% случаев у детей с миокардиодистрофией.
Существенную помощь в диагностике миокардиодистрофии оказывают данные суточного мониторирования ЭКГ. Нарушения процессов реполяризации при миокардиодистрофии чаще являются транзиторными (60%), реже регистрируются на протяжении всего времени исследования. На фоне физической нагрузки отмечается ухудшение процессов реполяризации в виде углубления отрицательного зубца Т, что часто сопровождается кратковременной депрессией сегмента ST. Данные анализа вариабельности сердечного ритма при суточном мониторировании ЭКГ позволяют выявить у трети детей с миокардиодистрофией усиление симпатических влияний на ритм сердца в виде снижения показате лей функции разброса, повышения функции концентрации сердечного ритма, что сочетается со снижением парасимпатических влияний.
Эхокардиография является обязательным методом диагностики миокардиодистрофии. Она позволяет провести дифференциальную диагностику для исключения органической патологии сердца и выявить начальные признаки ремоделирования сердечной мышцы. Эхокардиометрические и эхокинетические показатели у детей с миокардиодистрофией в большинстве случаев сохраняются в пределах нормативных значений. Вместе с тем у части детей (10%) определяются признаки процесса ремоделирования сердечной мышцы, отмечается тенденция к снижению глобальной сократительной способности миокарда. У половины детей с миокардиодистрофией выявляются малые аномалии развития сердца.
Проба с дозированной физической нагрузкой позволяет оценить динамику процесса реполяризации, адаптацию гемодинамических параметров к физической нагрузке, определить уровень физических нагрузок у детей с миокардиодистрофией.
Результаты наших исследований позволили выделить три стадии течения миокардиодистрофии у детей. Стадия компенсации характеризуется лабильными адренозависимыми нарушениями процессов реполяризации, отсутствием нарушений адаптации гемодинамики к дозированной физической нагрузке. Стадия декомпенсации характеризуется стабильными, диффузными нарушениями процессов реполяризации, дезадаптивным вариантом адаптации гемодинамики к дозированной физической нагрузке, признаками ремоделирования сердечной мышцы. Стадия субкомпенсации занимает промежуточное положение.
Патология энергообмена, а именно нарушение клеточного дыхания и окислительного фосфорилирования является основным патогенетическим механизмом возникновения миокардиодистрофии. Данные изменения могут быть генетически детерминированы или возникать вторично на фоне гипоксии и вегетативного дисбаланса. Ранняя диагностика нарушений процессов клеточной энергетики возможна на основании определения уровня молочной и пировиноградной кислот на фоне стандартного глюкозотолерантного теста. У пациентов с миокардиодистрофией отмечается высокая частота гиперлактатемии (66,7%) и гиперпируватемии (76,7%). Эти изменения отражают смещение процессов энергообразования в сторону анаэробного гликолиза, что энергетически невыгодно. Сдвиг метаболизма углеводов в анаэробную сторону чаще выявляется у детей с отрицательной реакцией на калий обзидановую пробу, со снижением толерантности и нарушениями гемодинамики при проведении пробы с дозированной физической нагрузкой.
Определение цитохимической активности митохондриальных ферментов в лимфоцитах периферической крови (сукцинатдегидрогеназы (СДГ), альфа-глицерофосфатдегидрогеназы (ГФДГ), глутаматдегидрогеназы, лактатдегидрогеназы) позволяет оценить процессы окислительного фосфорилирования (цикл Кребса), осуществляемого в митохондриях, что отражает степень дистрофических изменений и определяет прогноз течения патологии, а также необходимый объем терапии. Снижение активности СДГ и повышение активности ГФДГ является маркером декомпенсированной стадии миокардиодистрофии вследствие нарушения энергообмена.
Кардиомиопатии
Кардиомиопатии (КМП) – редкая, но крайне тяжелая патология сердца, характеризующаяся структурной перестройкой миокарда, развитием хронической сердечной недостаточности и неблагоприятным прогнозом. Существует три основных варианта КМП: дилатационная, гипертрофическая и рестриктивная. Выраженные метаболические изменения, обусловленные вторичными нарушениями митохондриальных функций, возникают при КМП вследствие развития хронической сердечной недостаточности и ишемического повреждения миокарда.
Нами установлено, что при дилатационной КМП существует сопряженность между степенью нарушений функции митохондрий и стадией заболевания. Дилатационная КМП в стадии компенсации сопровождается слабовыраженной митохондриальной дисфункцией. Стадия декомпенсации, характеризующаяся ишемическими изменениями в миокарде, хронической сердечной недостаточностью II Б степени, сочетается с выраженными нарушениями функции митохондрий гипоксического характера.
У больных с гипертрофической КМП степень митохондриальной дисфункции зависит от формы заболевания. При асимметричной обструктивной гипертрофической КМП митохондриальная дисфункция возникает в стадии декомпенсации на фоне выраженных ишемических изменений в миокарде. У больных с симметричной ГКМП часто выявляется выраженная митохондриальная дисфункция, даже при отсутствии признаков недостаточности кровообращения, что в большинстве случаев сочетается с выраженными экстракардиальными симптомами митохондриальной недостаточности.
Экспериментальными и клиническими исследованиями последних лет установлено, что при КМП существуют нарушения окислительного фосфорилирования, связанные с количественными и функциональными изменениями митохондрий вследствие мутации митохондриальной или ядерной ДНК. Это позволило выделить особую группу митохондриальных КМП. Причиной этих КМП часто является генетически детерминированный дефицит комплексов цепи дыхательных ферментов митохондрий.
Во многих исследованиях показано, что КМП сочетаются с резким снижением уровня карнитина в митохондриях. Причиной карнитиновых КМП может быть генетический дефект транспорта карнитина. Вторично дефицит карнитина возникает при нарушении функции транспортных энзимов – карнитиновых трансфераз, осуществляющих перенос карнитина к ацильным компонентам коротких, средних и длинных цепей жирных кислот, а также на фоне органических ацидемий.
Биохимическими критериями диагностики метаболических нарушений при КМП являются повышение уровня лактата (более 2,5 ммоль/л) и пирувата (более 0,2 ммоль/л), увеличение соотношения лактат/пируват (более 20), лактат ацидоз, транзиторная гипогликемия, повышение уровня органических жирных кислот, снижение уровня карнитина в плазме. Митохондриальный генез КМП верифицируется на основании снижения уровня митоходриальных ферментов в фибробластах или нейтрофилах, низкой активности комплексов цепи дыхательных ферментов митохондрий, выявления повышенного количества RRF (более 5%) в биоптатах скелетной мышцы, отложения липидов и гликогена, аномалии структуры митохондрий, нарушений активности митохондриальной цитохромоксидазы и/или сукцинатдегидрогеназы.
Энерготропная терапия
В настоящее время установлено, что митохондриальная дисфункция при миокардиодистрофии поддается терапевтической коррекции. Применяется комплексная терапия, включающая препараты, стимулирующие бетаокисление жирных кислот, активирующие перенос электронов в дыхательной цепи митохондрий (Коэнзим Q10, цитохром С), кофакторы энзимных реакций энергетического обмена. Карнитин регулирует процессы энергообразования в клетке, осуществляет транспорт длинноцепочечных жирных кислот в митохондрии с образованием большого количества АТФ. Именно за счет бета окисления жирных кислот образуются 60–80% запасов энергии в митохондриях. Следует подчеркнуть, что только L изомер карнитина обладает биологически активными свойствами.
С 2000 года российская компания «ПИК ФАРМА» выпускает лекарственный препарат на основе природного L-карнитина – Элькар® (левокарнитин) в виде 20% ного раствора для перорального применения. Новорожденным его рекомендуют давать во время кормления по 0,03–0,075 г 2 раза в день. Детям до года назначают по 0,075 г 3 раза в день, детям от года до 6 лет – в дозе 70 мг/кг в сутки, старше 6 лет – в суточной дозе 50 мг/кг, подросткам – 40 мг/кг в сутки. Для лечения миокардиодистрофии и КМП рекомендуется назначение препарата Элькар в дозе 50–75 мг/кг в сутки, максимальная доза – 2 г в сутки. При лечении карнитиновых кардиомиопатий на фоне первичной или вторичной карнитиновой недостаточности (дефицит ацил КоАдегидрогеназ жирных кислот, органические ацидурии, транспортные дефекты переноса карнитина) доза карнитина увеличивается до 100 мг/кг в сутки. Максимальная доза – до 3 г в сутки.
Показана эффективность комплексной кардиотрофической терапии, включающей L-карнитин (50–75 мг/кг/ в сутки) в сочетании с кофакторами энергетического обмена (липоевая кислота, кальция пантотенат, кальция пангомат, витамины В1 и В6) у детей с миокардиодистрофией. На фоне проводимой терапии отмечается увеличение толерантности к физической нагрузке, улучшение процессов реполяризации, устранение гиперлактатемии и гиперпируватемии, нормализация размеров полости левого желудочка и сократимости миокарда.
Своевременная терапия L-карнитином кардиомиопатий, возникающих на фоне первичного или вторичного дефицита карнитина, предотвращает развитие сердечной недостаточности, позволяет избежать неблагоприятного течения заболевания. На фоне лечения заболевания высокими дозами L-карнитина (Элькара) возможно полное исчезновение симптоматики. Применение L-карнитина показано не только при лечении митохондриальных КМП, но и при лечении идиопатических КМП, при которых нарушения клеточной энергетики носят вторичный характер, обусловленный развитием сердечной декомпенсации. Следует подчеркнуть, что при идиопатических КМП гораздо реже встречается дефицит карнитина в плазме. Несмотря на это применение препарата Элькар (L-карнитин) в составе комбинированной терапии сердечной недостаточности оказывает положительное влияние на показатели функционального состояния миокарда.
Кардиомиопатия при метаболических нарушениях (I43.1*)
Амилоидоз – группа заболеваний, общим признаком которых является отложение в органах и тканях особого белка β -фибриллярной структуры. Термин “амилоид” введен в 1854 г. Рудольфом Вирховым, подробно изучившим вещество, которое откладывается в тканях при так называемой “сальной” болезни у больных сифилисом, туберкулезом, актиномикозом . При дальнейшем изучении была установлена белковая природа амилоида, а спустя 100 лет после наблюдений Р. Вирхова, показана его фибриллярная структура при помощи электронного микроскопа.

Автоматизация клиники: быстро и недорого!
– Подключено 300 клиник из 4 стран
– 800 RUB / 4500 KZT / 27 BYN – 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место – 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Классификация амилоидоза ВОЗ (1993)
В классификации приводится тип амилоидоза, затем указывается белок-предшественник, потом клиническая форма. Среди системных амилоидозов почек выделяют: АА, AL, ATTR, Аβ2М-диализный амилоидоз.
АА-амилоидоз объединяет вторичный или реактивный амилоидоз при следующих заболеваниях:
– периодическая болезнь;
– анкилозирующий спондилоартроз (болезнь Бехтерева);
– ревматоидный артрит – РА (43%);
– системная красная волчанка (СКВ);
– псориатический артрит;
– рак почки;
– лимфома;
– лимфогранулематоз;
– неспецифический язвенный колит;
– болезнь Крона.
AА-амилоидоз также часто встречается при гнойно-деструктивных процессах, туберкулезе и т.д.
AL-амилоидоз включает:
– первичный идиопатический амилоидоз;
– амилоидоз при множественной миеломе;
– амилоидоз при В-клеточных опухолях;
– амилоидоз при болезни Вальденстрема.
Предшественником AL-амилоидоза служат легкие цепи моноклонального Igλ и Х-типов.
Основные органы-мишени: желудочно-кишечный тракт (ЖКТ), сердце, почки.
ATTR-амилоидоз включает:
– семейную амилоидную полинейропатию;
– семейную амилоидную кардиопатию;
– старческий амилоидоз (у лиц, старше 70 лет).
Аβ2М-диализный амилоидоз является новой формой системного амилоидоза.
Аβ-амилоидоз развивается при болезни Альцгеймера, иногда регистрируются семейные случаи.
AJAPP – амилоидоз островков Лангерганса при II типе сахарного диабета и инсулиноме.
Варианты старческого амилоидоза сердца:
– диффузные интерстициальные фибриллярные отложения в миокарде;
– мультифокальный массивный амилоидоз миокарда;
– диффузный (интерстициальный, сетчатый, псевдогипертрофический) кардиальный амилоидоз коронарных артерий (мультинодулярный стенозирующий коронарный амилоидоз);
– амилоидоз аорты.
Этиология и патогенез
Амилоидная кардиопатия развивается при первичной (идиопатической) системной семейной кардиопатической и старческой формах амилоидоза.
При первичном амилоидозе амилоид наиболее часто откладывается вокруг коллагена в строме органа, вследствие этого миокард утолщается и уплотняется (“резиновый” миокард), иногда не спадается на вскрытии. Эти свойства миокарда являются причиной резкого снижения его податливости. Кардиопатический амилоидоз является типичным вариантом рестриктивной кардиомиопатии.
При первичном амилоидозе увеличение массы миокарда в некоторых случаях бывает настолько выраженным, что на вскрытии сердце занимает большую часть грудной клетки. Отложения амилоида делают миокард ригидным, но полости желудочков не дилатированы, зато предсердия резко расширены, в результате чего сердце на рентгеновском снимке имеет форму “боксерской перчатки”. В результате резкого утолщения стенок сердца, оно внешне несколько напоминает гипертрофическую кардиомиопатию.
У пациентов с кардиопатическими формами идиопатического или семейного амилоидоза, развивается хроническая сердечная недостаточность (при нерасширенных желудочках сердца) вследствие невозможности адекватного расслабления желудочков в диастолу.
У некоторых пациентов амилоид откладывается на клапанах сердца, что вызывает регургитацию потока крови, которая клинически проявляется систолическим шумом. Как результат в обоих желудочках возникают резкое повышение конечного дистолического давления, снижение сердечного выброса, а в дальнейшем и снижение сократимости левого желудочка.
Эпидемиология
Амилоидоз сердца более часто развивается в возрасте выше 40 лет; у мужчин отмечается чаще, чем у женщин.
Факторы и группы риска
– у больных с заболеваниями сердца при диагностированном AL-амилоидозе и/или патологии плазматических клеток;
– при дисфункции желудочков или желудочковых нарушениях ритма у больных с длительно существующими системными заболеваниями соединительной ткани или другими хроническими воспалительными заболеваниями;
– у пациентов с хронической сердечной недостаточностью, рефрактерной к стандартному медикаментозному лечению.
Факторы риска амилоидоза:
– заболевания с поражением клонов плазматических клеток;
– хронические воспалительные заболевания;
– семейная средиземноморская лихорадка (семейный пароксизмальный полисерозит);
– гемодиализ – амилоид состоит из |32-микроглобулина (109700, 15q21-q22, ген B2М), который в норме выводится из организма почками, но не удаляется при гемодиализе.
Клиническая картина
Cимптомы, течение
Амилоид может откладываться в мелких сосудах миокарда с развитием микроциркуляционной стенокардии (синдром X). Аутопсия может и не выявить амилоид в самом миокарде, который не имеет внешних отличий от непораженных участков.
Диагностика
ЭхоКГ-признаки при амилоидозе сердца:
1. Дилатация верхней и нижней полых, печеночных и легочных вен. Инспираторный коллапс нижней полой вены, присутствующий в норме, может быть резко снижен или отсутствует.
2. Маленькие полости желудочков при большом размере предсердий.
3. Снижение скоростей потока в печеночных венах на вдохе и реверсия диастолического потока на вдохе.
4. Увеличение конечно-диастолической толщины межжелудочковой перегородки (МЖП) ≥ 12 мм при отсутствии каких-либо иных причин гипертрофии (артериальная гипертензия, аортальный стеноз).
5. Гомогенное утолщение атриовентрикулярных клапанов (часто сопровождается небольшой регургитацией).
6. Диффузное утолщение других стенок сердца, включая стенку правого желудочка и межпредсердную перегородку.
ЭКГ-изменения при амилоидозе сердца:
– низкий вольтаж без специфических изменений реполяризации или сочетание низкого вольтажа и эхокардиографических признаков большой массы миокарда;
– патологические зубцы Q, “симулирующие” инфаркт миокарда;
– аритмии и нарушения проводимости.
Радиоизотопная диагностика амилоидоза сердца показывает значительное повышение накопления изотопа в миокарде.
Исследование биоптата стенки прямой кишки (слизистого и подслизистого слоев) является информативным методом при АL и при АА-амилоидозе. Вероятность выявления амилоида таким методом составляет 50-70%. В случае биопсии пораженного органа (почки, сердца, печени и др.) положительные результаты достигают 90%. Показано, что чем больше инфильтрация амилоидом основного органа-мишени, тем больше вероятность его выявления в иных местах (к примеру в десне или прямой кишке).
Лабораторная диагностика
При амилоидозе специфические лабораторные изменения отсутствуют.
Характерны значительно повышение СОЭ (50-70 мм/ч) и анемия (в ряде случаев отмечаются гиперфибриногенемия, тромбоцитоз).
Применяются специальные пробы на амилоид (с конгорот, метиленовой синью, которые в норме изменяют окраску мочи, но у больных амилоидозом они фиксируются амилоидом и выводятся с мочой в минимальных количествах) и электрофоретическое исследование белков мочи.
Дифференциальный диагноз
1. Гипертрофическая кардиомиопатия – дифференциальная диагностика с кардиомиопатией при амилоидозе значительно затруднена при наличии сердечной недостаточности. ЭхоКГ в обоих случаях выявляет утолщение миокарда желудочков (иногда асимметричное), преимущественно межжелудочковой перегородки и ее гипокинезия. Некоторое значение для дифференциации имеет отсутствие у пациентов с амилоидной кардиомиопатией III тона и признаков гипертрофии левого желудочка на ЭКГ, которые характерны для гипертрофической кардиомиопатии. Тем не менее, при отсутствии системных проявлений амилоидоза, уточнить диагноз возможно только при помощи эндомиокардинальной биопсии.
2. Констриктивный перикардит – в отличие от амилоидной кардиомиопатии, стенокардия, нарушения проводимости, гипертрофия левого желудочка при ЭхоКГ и признаки его систолической дисфункции.
3. Идиопатическая рестриктивная кардиомиопатией (эндомиокардиальная болезнь). Дифференциация основана на типичных отличиях морфофункционального состояния левого желудочка по данным ЭхоКГ и характера нарушений его диастолического наполнения при радионуклидной вентрикулографии и катетеризации сердца. В обоих случаях важным диагностическим значением обладает выявление внесердечного амилоидоза.
4. Ишемическая болезнь сердца – дифференцируют с кардиомиопатией при амилоидозе (особенно сенильном) у пожилых пациентов, страдающих стенокардией, сердечной недостаточностью и крупноочаговыми изменениями на ЭКГ. В пользу амилоидоза свидетельствуют выраженные клинические и инструментальные признаки снижения диастолической податливости миокарда левого желудочка в сочетании с низким вольтажем зубцов ЭКГ.
Лечение
Цель лечения амилоидоза (первичного и вторичного) – уменьшение синтеза и доставки предшественников, из которых строится белок амилоида.
Применяются различные схемы полихимиотерапии. Эффективна комбинация мелафлана с преднизолоном. Применяется схема: мелфалан через каждые 4-6 недель 7-дневными курсами (0,15 мг/кг массы тела) в сочетании с преднизолоном (0,8 мг/кг массы тела).
Лечение продолжительное, не менее 1 года.
Затруднено лечение ХСН у больных АL-амилоидозом. Это связано с повышенной чувствительностью к сердечным гликозидам, усугублением ХСН на фоне приема ингибиторов кальциевых каналов и развитием угрожающих жизни нарушений проводимости при назначении бета-адреноблокаторов. По сути лечение сводится к назначению массивных доз мочегонных средств.
При синдроме слабости синусового узла малоперспективно применение искусственного водителя ритма, поскольку пациенты могут погибнуть от прочих нарушений ритма и проводимости.
В настоящее время для лечения амилоидной кардиомиопатии начинают применять трансплантацию сердца.
Прогноз
Системный амилоидоз имеет прогрессирующее течение. Прогноз зависит от формы амилоидоза, сроков диагностики и степени вовлечения жизненно важных органов. Средний показатель выживаемости при естественном течении АL-амилоидоза составляет 1-2 года. Наиболее низкая выживаемость отмечена у пациентов с хронической сердечной недостаточностью, синдромом мальабсорбции Синдром мальабсорбции (мальабсорбция) – сочетание гиповитаминоза, анемии и гипопротеинемии, обусловленное нарушением всасывания в тонкой кишке
и ортостатической гипотонией (6-9 месяцев).
Профилактика
Профилактика первичного амилоидоза не разработана.
Профилактика вторичного амилоидоза заключается в своевременном выявлении и адекватном лечении заболеваний, которые могут способствовать его развитию.
Метаболические нарушения в миокарде
При изучении ишемической дисфункции левого желудочка (ИДЛЖ) необходимо помнить, что данный вид нарушений имеет скрытую картину. ИДЛЖ не однозначен с сердечной недостаточностью в виде циркуляторных нарушений. Задолго до этой стадии в деятельности сердца могут быть выявлены изменения функционального характера, которые из-за широких возможностей компенсации за счет регуляторных и периферических механизмов не выявляются в виде застоя или недостаточности выброса.
Дисфункция левого желудочка может протекать в различных формах, зависящих от механизма и тяжести ишемических повреждений.
Наиболее распространенная форма — кратковременная обратимая ишемия, которая возникает во время приступа стенокардии и может быть выявлена только во время стенокардии или в течение 10—15 минут после восстановления коронарного кровотока. Такая ишемия бывает явной, когда сопровождается болевым приступом или может проявиться в виде одышки, аритмии или скрытой латентной ишемии.
Ишемия может быть длительной, но обратимой, что характерно для нестабильной стенокардии, когда дисфункция левого желудочка продолжается неопределенно долго (много часов, дней и даже недель) после восстановления кровообращения. Ишемия может быть и необратимой, когда при непрерывной окклюзии коронарного сосуда свыше 60—90 минут без восстановления кровотока в области ишемии развивается некроз миокарда.
В настоящее время имеются значительные клинико-инструментальные и биохимические исследования на уровне миоцитов, объясняющие интимный механизм ишемических изменений в миокарде.
Метаболические нарушения ишемии миокарда
Падение содержания кислорода влечет за собой аккумуляцию ионов водорода (Н+). Ацидоз немедленно нарушает ионное равновесие. Ионы кальция (Са++) из! контрактильных протеинов выводятся в саркоплазматический ретикулум. Масса внутриклеточного натрия (Na+) нарастает, калий (К+) покидает клетку миокарда. Нарастание Са++ в ретикулуме, повышение активности Са++-АТФазы, липаз приводит к нарушению структуры клеточных мембран, Са++ скапливается в митохондриях, что приводит к их разрушению.
Накопление Na+ внутри клетки чревато ее набуханием и отеком. Перегрузка митохондрий Са++ способствует снижению продукция АТФ.
Повышение содержания Н+ ионов приводит и ко второму важнейшему компоненту нарушения метаболизма — появлению перекисных соединений (суперокисных анионов гидроксильных радикалов и свободных О++ радикалов). Последние оказывают выраженный цитотоксический эффект, обусловлявая повреждение миоцитов клеточных мембран. Нарушается структура белков (клоны). Все эти сдвиги начинаются с первых 30—60 секунд ишемии миокарда.
При продолжении состояния кислородного голодания к этим нарушениям присоединяется каскад сдвигов компонентов, связанных с воспалительными изменениями. К месту нарушения устремляются гранулоциты. Они приводят к обструкции капилляров, что повышает вязкость крови, и нарастанию явлений ишемии.
Нарастание, а затем и распад лейкоцитов влекут за собой нарушение арахидонового метаболизма и, как следствие, прогрессирование разрушения мембраны клеток с дальнейшим выходом Са++.
Метаболические нарушения приводят и к микроструктурным повреждениям, Обнаруживается набухание и отек миоцитов, нарушение мембран, клеточные контрактуры. При выраженных повреждениях разрушаются ядра клеток. Интенсивность ишемических нарушений определяется не только степенью окклюзии коронарных сосудов. Имеет значение скорость развития стеноза, наличие коллатералей, поддерживающих уровень кровоснабжения, особое значение имеет длительность периода ишемизации миокарда.
При ограничении кровотока более чем до 80% при быстром закрытии коронарного сосуда уже через 60—90 мин изменения в клетках делаются необратимыми, развивается некроз миоцитов; Вместе с тем даже кратковременные, но повторяющиеся эпизоды ишемии, могут являться причиной необратимых морфологических изменений. Во всех случаях длительных однократных или повторяющихся эпизодов ишемии развиваются фиброзные изменения, появляются участки гипертрофии миокарда, что обусловлено развитием перегрузки сердца в связи с ишемическими повреждениями.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Метаболический синдром: симптомы и диагностика нарушений обмена веществ
Еще недавно метаболическим синдромом страдали преимущественно пожилые люди (старше 60 лет). Картина существенно изменилась за последние 20 лет. Динамика показала, что эта проблема молодеет и становится актуальной для более юного населения. В ряде стран доля взрослого населения, страдающая от этих симптомов, достигает 25%.
У метаболического синдрома есть еще одно название – «синдром нового мира». Дело в том, что преимущественно от ожирения и связанных с ним патологий страдают люди, ведущие малоподвижный образ жизни (а это касается преобладающего числа жителей больших городов), употребляющие большое количество быстрых углеводов и трансжиров. В результате во всем мире наблюдается всплеск сердечно-сосудистых заболеваний и диабета.
Метаболический синдром затрагивает как развитые страны (где высокотехнологичное производство избавило население от необходимости много двигаться), так и развивающиеся (большому проценту населения которых приходится экономить на продуктах питания и потреблять больше быстрых углеводов – макарон, хлеба, картофеля, кукурузы).
Есть и другая тенденция последних лет. От метаболического синдрома стали страдать женщины репродуктивного возраста. С чем это связано, до конца неясно. Предположительно, могут негативно влиять оральные контрацептивы.
Только представьте: за последние 20 лет число людей с метаболическим синдромом в мире выросло более чем на 100 млн – то есть на треть.
Особенно остро стоит проблема детского ожирения, а с ним и детского МС. Ученые связывают рост детского ожирения с частым отказом от грудного вскармливания. Грудное вскармливание исключает раннее введение прикорма, которое может привести к нездоровому увеличению веса. Потребление белка и общего количества энергии выше у детей, вскармливаемых смесями, что приводит к увеличению массы тела у младенцев. Также кормление смесью несколько увеличивает уровень инсулина, что в свою очередь способствует отложению жира и раннему развитию жировых клеток (адипоцитов).
Таким образом, быстрая прибавка в весе в младенческом возрасте связана с ожирением в детстве. Грудное вскармливание может помочь «запрограммировать» человека на поддержание здорового веса во взрослом возрасте.
В чем причины?
Главная причина, по которой развивается метаболический синдром, – внешние факторы: неправильное питание, малая подвижность. Эти вредные привычки в конечном счете нарушают нормальное функционирование жировой ткани и ведут к инсулинорезистентности.
Метаболический синдром имеет наследственную предрасположенность, которая, однако, в большей степени тоже объясняется внешними факторами. Люди, выросшие в одной семье, с большей вероятностью будут иметь схожие пищевые привычки и одинаковое отношение к спорту. Если на родительском столе бывает огромное количество быстрых углеводов и жиров и мало – овощей, зелени и фруктов, у ребенка с детства закладываются нездоровые отношения с едой. Так же и со спортом: ребенок с большей вероятностью будет активным, если у него активные родители.
Факторы риска
- Пожилой возраст. Чем старше человек, тем, согласно статистике, выше риск развития метаболического синдрома.
- Этническая принадлежность. Латиноамериканцы подвергаются наибольшему риску развития метаболического синдрома. Но это не значит, что россияне не страдают от данного заболевания.
- Ожирение. Как уже было сказано в начале, лишний вес повышает шансы заработать МС.
- Сахарный диабет. Вероятность получить метаболический синдром растет, если у пациентки был диабет во время беременности (гестационный диабет). Диабет 2 типа в семейной истории – тоже повод для пристального внимания за здоровьем.
- Прочие болезни. Риск метаболического синдрома выше, если у пациента был жировой гепатоз, синдром поликистозных яичников или апноэ во сне.
Осложнения
- Сахарный диабет 2 типа. Если не изменить образ жизни и не взять лишний вес под контроль, может развиться инсулинорезистентность, что может вызвать повышение уровня сахара в крови. В конечном итоге она приводит к диабету 2 типа.
- Заболевания сердца и сосудов. Высокий уровень холестерина и высокое кровяное давление способствуют образованию бляшек в артериях. Эти бляшки сужают артерии, что может привести к сердечному приступу или инсульту.
Диагностика метаболического синдрома
Диагностика МС состоит из визуального осмотра у врача и лабораторных и инструментальных исследований. В первую очередь врач оценивает абдоминальное ожирение. Но одного лишнего веса для постановки диагноза недостаточно. Оцениваются и другие симптомы и результаты анализов. Также важно обнаружить причину ожирения. Лишний вес может быть следствием эндокринных нарушений, гормональных сбоев или иных патологий.
Другой важный критерий при постановке диагноза – артериальное давление. При метаболическом синдроме оно обычно повышено.
ЭКГ – требуется, чтобы проверить работу сердца и вовремя обнаружить патологии, если заболевание уже запущенно.
Ангиография. Сложное исследование, которое позволяет оценить состояние сосудов. Проводится только по назначению врача.
-
. Первый и самый информативный анализ. При МС уровень сахара в плазме существенно повышен.Более подробную информацию об обмене глюкозы можно получить, сдав анализ крови на гликозилированный гемоглобин (HBA1c), который отражает среднее содержание глюкозы в крови за последние 3 месяца. . Для диагностики важно знать уровень липидов низкой и высокой плотности (ЛПНП и ЛПВП), холестерол общий, триглицериды. При МС эти показатели не соответствуют норме, в крови увеличивается содержание «вредных» жиров, которые увеличивают риск бляшек в сосудах. . Его уровень при МС тоже обычно повышается. . Повышенный уровень этой аминокислоты повышает риск образования тромбов и проблем с сердцем и сосудами. . Маркер воспалительных процессов в организме. При метаболическом синдроме его уровень часто превышает границу нормы.
Диагностика метаболического синдрома – непростая комплексная задача, которая осложняется разнообразием форм заболевания, его причинами и способами коррекции. Также это состояние опасно тем, что долгие годы человек не ощущает себя больным. Самочувствие начинает страдать, когда появляются значительные отклонения в работе организма и развиваются осложнения. Ни один человек не может ощутить повышенный уровень глюкозы в крови или нарушение обмена холестерина. О себе дают знать только уже очень серьезные проблемы, вызванные этими нарушениями, – например, гнойное воспаление пальцев ног или сердечный приступ.
Международная классификация болезней не выделяет метаболический синдром как отдельное заболевание, это целый комплекс заболеваний.
Ни один диагноз нельзя поставить самостоятельно, но любое отклонение в результатах исследований – повод не откладывать поход к врачу.
Лечение
- изменение образа жизни;
- лечение ожирения;
- лечение нарушений углеводного обмена;
- лечение артериальной гипертонии;
- лечение дислипидемии.
В более запущенных формах может потребоваться применение препаратов, снижающих инсулинорезистентность, и лечащих артериальную гипертонию.
Миокардиодистрофия
Миокардиодистрофия – вторичное поражение миокарда, обусловленное метаболическими нарушениями и приводящее к дистрофии и дисфункции сердечной мышцы. Миокардиодистрофия сопровождается кардиалгией, перебоями сердечного ритма, умеренной тахикардией, быстрой утомляемостью, головокружением, одышкой. Диагностика миокардиодистрофии основывается на данных анамнеза и клиники, электрокардиографии, фонокардиографии, рентгенографии, эхокардиографии, МРТ, сцинтиграфии, биохимического исследования крови и др. Лечение миокардиодистрофии предполагает проведение патогенетической терапии кардиотрофиками и симптоматической терапии антиаритмическими, антигипертензивными препаратами, сердечными гликозидами и т. д.
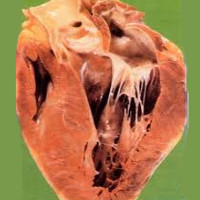
Общие сведения
Термином «миокардиодистрофия» (вторичная кардиомиопатия, дистрофия миокарда) в кардиологии объединяют группу невоспалительных и недегенеративных поражений миокарда, сопровождающихся выраженным расстройством обменных процессов и значительным снижением сократительной способности сердечной мышцы. Миокардиодистрофия всегда является вторичным процессом, включающим дисметаболические, электролитные, ферментные, нейрогуморальные и вегетативные нарушения. Миокардиодистрофия характеризуется дистрофией миоцитов и структур проводящей системы сердца, что ведет к нарушению основных функций сердечной мышцы – сократимости, возбудимости, автоматизма, проводимости.
Миокардиодистрофия, особенно на своих начальных стадиях, имеет, как правило, обратимый характер, что отличает ее от дегенеративных изменений миокарда, возникающих при гемохроматозе и амилоидозе сердца.

Причины миокардиодистрофии
К миокардиодистрофии могут приводить самые различные внешние и внутренние факторы, нарушающие протекание обмена веществ и энергии в миокарде. Миокардиодистрофия может развиваться под влиянием:
- острых и хронических экзогенных интоксикаций (алкогольной, лекарственной, промышленной и др.), физических агентов (радиации, вибрации, перегревания);
- эндокринных и обменных нарушений (тиреотоксикоза, гипотиреоза, гиперпаратиреоза, сахарного диабета, ожирения, авитаминоза, синдрома Кушинга, патологического климакса);
- системных заболеваний (коллагенозов, нейромышечной дистрофии),
- инфекций (хронического тонзиллита и др.), болезней пищеварительной системы (цирроза печени, панкреатита, синдрома мальабсорбции).
Причинами миокардиодистрофии у новорожденных и детей раннего возраста могут быть перинатальная энцефалопатия, внутриутробные инфекции, синдром дезадаптации сердечно-сосудистой системы на фоне гипоксии.У спортсменов миокардиодистрофия может возникать в результате чрезмерного физического перенапряжения (патологическое спортивное сердце).
Патогенез
Различные неблагоприятные факторы вызывают расстройство электролитного, белкового, энергетического обмена в кардиомиоцитах, накопление патологических метаболитов. Изменения биохимических процессов в миокарде приводят к нарушению сократительной функции мышечных волокон, различным нарушениям ритма и проводимости, сердечной недостаточности. При устранении этиологического фактора трофические процессы в миоцитах могут полностью восстанавливаться. Однако при длительном неблагоприятном воздействии происходит гибель части кардиомиоцитов и их замещение соединительной тканью – формируется кардиосклероз.
Клинические формы миокардиодистрофии
Миокардиодистрофия при анемиях
Нарушения в миокарде развиваются при уменьшении гемоглобина до 90-80 г/л. На этом фоне развивается гемическая гипоксия, сопровождающаяся энергетическим дефицитом в миокарде. Анемическая миокардиодистрофия может возникать при железодефицитной и гемолитической анемии, при острой и хронической кровопотере, ДВС-синдроме.
Клиническими проявлениями миокардиодистрофии при анемии служат бледность кожных покровов, головокружение, одышка, тахикардия, усиление пульсации сонных артерий. Перкуторное исследование выявляет расширение границ сердца, свидетельствующее о гипертрофии миокарда. Аускультативно обнаруживаются громкие тоны сердца, систолические шумы над сердцем и сосудами, «шум волчка» на шейных сосудах. Сердечная недостаточность развивается при длительной анемии и неадекватном лечении.
Миокардиодистрофия при тиреотоксикозе
Под влиянием избыточного количества тиреоидных гормонов в сердечной мышце снижается синтез аденозинтрифосфорной кислоты (АТФ) и креатинфосфата (КФ), что сопровождается энергетическим, а затем и белковым дефицитом. В то же время, тиреоидные гормоны стимулируют активность симпатической нервной системы, вызывая увеличение ЧСС, минутного объема крови, скорости кровотока, ОЦК. В таких условиях изменение внутрисердечной гемодинамики не может быть подкреплено энергетически, что в итоге приводит к развитию миокардиодистрофии.
В клинике миокардиодистрофии при тиреотоксикозе преобладают аритмии (синусовая тахикардия, экстрасистолия, пароксизмальная тахикардия, мерцательная аритмия). Длительный тиреотоксикоз вызывает хроническую недостаточность кровообращения, преимущественно по правожелудочковому типу, которая проявляется болями в области сердца, отеками, гепатомегалией. Иногда при тиреотоксикозе доминируют симптомы миокардиодистрофии, в связи с чем пациенты обращаются, в первую очередь, к кардиологу, а уже затем попадают к эндокринологу.
Миокардиодистрофия при гипотиреозе
Патогенетической основой миокардиодистрофии при гипотиреозе служит дефицит тиреоидных гормонов, ведущий к снижению активности метаболизма в миокарде. При этом в результате повышения проницаемости сосудов происходит задержка жидкости в миоцитах, что сопровождается развитием дисметаболических и электролитных нарушений (повышением содержания натрия и уменьшением калия).
Миокардиодистрофия при гипотиреозе характеризуется постоянными ноющими болями в сердце, аритмиями (синусовой брадикардией), блокадами (предсердной, атриовентрикулярной, желудочковыми).
Алкогольная и токсическая миокардиодистрофия
Считается, что к алкогольной миокардиодистрофии приводит ежедневный прием 80-100 мл этилового спирта на протяжении 10 лет. Однако при наследственном дефиците ряда ферментов, расщепляющих этанол, стрессах, частых вирусных инфекциях миокардиодистрофия может развиться и в более короткие сроки – за 2-3 года даже при употреблении меньших количеств алкоголя. Алкогольная миокардиодистрофия встречается преимущественно у мужчин 20—50 лет.
Токсическая миокардиодистрофия встречается у лиц, получающих длительную терапию иммунодепрессантами (цитостатиками, глюкокортикостероидами), НПВП, некоторыми антибиотиками, транквилизаторами, а также при отравлениях хлороформом, фосфором, мышьяком, угарным газом и т. д. Такие варианты миокардиодистрофии могут протекать в кардиалгической (болевой), острой аритмической, сочетанной и застойной формах.
Кардиалгическая форма миокардиодистрофии характеризуется щемящими или ноющими болями в грудной клетке, преходящим ощущением жара или зябкости конечностей, потливостью. Больных беспокоит общая слабость, быстрая утомляемость, снижение физической выносливости, головные боли.
Аритмическая форма миокардиодистрофии сопровождается тахикардией, нарушениями ритма и проводимости сердца (синусовой тахи- или брадикардией, экстрасистолией, блокадами ножек пучка Гиса), иногда – приступами фибрилляции и трепетания предсердий. При сочетанной форме миокардиодистрофии отмечаются аритмии и кардиалгии. Проявления застойной миокардиодистрофии обусловлены сердечной недостаточностью и включают одышку при напряжении, кашель, приступы сердечной астмы, отеки на ногах, гидроперикард, гидроторакс, гепатомегалию, асцит.
Тонзиллогенная миокардиодистрофия
Поражения миокарда при тонзиллите возникают у 30—60% пациентов. Тонзиллогенная миокардиодистрофия обычно развивается после серии перенесенных ангин, протекающих с высокой лихорадкой и интоксикацией. В клинике тонзиллогенной миокардиодистрофии превалируют жалобы на боли в области сердца интенсивного характера, выраженную слабость, неритмичный пульс, одышку, очаговую или диффузную потливость, субфебрилитет, артралгии.
Миокардиодистрофия физического перенапряжения
Развивается у спортсменов, выполняющих физические нагрузки, которые превышают их индивидуальные возможности. В этом случае поражению миокарда могут способствовать скрытые хронические очаги инфекции в организме – синусит, тонзиллит, аднексит и пр.; отсутствие полноценного отдыха между тренировками и т. д. В отношении патогенеза миокардиодистрофии физического напряжения выдвинуто ряд теорий: гипоксическая, нейродистрофическая, стероидно-электролитная.
Данный вариант миокардиодистрофии в основном проявляется симптомами общего характера: слабостью, вялостью, быстрой утомляемостью, угнетенным настроением, снижением интереса к спорту. Может возникать сердцебиение, покалывание в области сердца, перебои.
Климактерическая миокардиодистрофия
Развивается вследствие дисгормональных процессов у женщин в возрасте 45 – 50 лет. Климактерическая миокардиодистрофия проявляется болями в области сердца давящего, колющего или ноющего характера, иррадиирующими в левую руку. Кардиалгии усиливаются в связи с «приливами», сопровождаются ощущением жара, учащенным сердцебиением, повышенной потливостью. Сердечная недостаточность при климактерической миокардиодистрофии может развиться при имеющейся сопутствующей артериальной гипертензии.
Диагностика миокардиодистрофии
У пациентов с миокардиодистрофией в анамнезе обычно выявляются заболевания или патологические состояния, сопровождающиеся тканевым гипоксическим синдромом и нарушением метаболических процессов. Объективное исследование сердца обнаруживает нерегулярный пульс, приглушение сердечных тонов, ослабление I тона на верхушке, систолический шум.
При электрокардиографии регистрируются различные аритмии, нарушения процессов реполяризации миокарда, снижение сократительной функции миокарда. Проведение нагрузочных и фармакологических проб при миокардиодистрофии, как правило, дает отрицательные результаты. Фонокардиография обнаруживает изменения соотношения длительности электрической и механической систолы, появление галопного ритма и систолического шума на основании и верхушке, приглушение тонов сердца. С помощью эхокардиографии определяется расширение камер сердца, изменение структуры миокарда, отсутствие органической патологии.
Выявляемая при рентгенографии грудной клетки миопатическая конфигурация сердца, свидетельствует о глубоком поражении миокарда. Сцинтиграфия позволяет оценить метаболизм и перфузию миокарда, выявить очаговые и диффузные дефекты накопления как, указывающие на снижение числа функционирующих кардиомиоцитов.
К биопсии сердечной мышцы прибегают в сомнительных случаях, при неинформативности неинвазивных исследований. Дифференциальный диагноз миокардиодистрофии проводится с ИБС, миокардитами, атеросклеротическим кардиосклерозом, легочным сердцем, пороками сердца.
Лечение миокардиодистрофии
Комплексная терапия миокардиодистрофии складывается из лечения основного заболевания, патогенетической (метаболической) и симптоматической терапии. В связи с этим лечебная тактика при миокардиодистрофии определяется не только кардиологом, но и узкими специалистами – гематологом, отоларингологом, эндокринологом, ревматологом, гинекологом-эндокринологом, спортивным врачом. Больным рекомендуется щадящий физический режим, исключение вредных профессиональных воздействий, контакта с химикатами, приема алкоголя и курения.
Метаболическая терапия миокардиодистрофии предполагает назначение витаминов группы В, кокарбоксилазы, АТФ, препаратов калия и магния, инозина, анаболических стероидов и других препаратов, улучшающих метаболические процессы и питание сердечной мышцы.
При сердечной недостаточности показаны диуретики, сердечные гликозиды; при аритмиях – противоаритмические средства. При климактерической миокардиодистрофии назначается ЗГТ, седативные и гипотензивные препараты. Этиотропная терапия тонзиллогенной миокардиодистрофии требует интенсивного лечения тонзиллита вплоть до тонзиллэктомии.
Прогноз и профилактика миокардиодистрофии
Обратимость изменений миокарда при миокардиодистрофии зависит от своевременности и адекватности лечения основного заболевания. Исходом длительно протекающей миокардиодистрофии служит миокардиосклероз и сердечная недостаточность.
Предупреждение миокардиодистрофии основано на устранении текущих заболеваний, учете возраста и физической подготовки при занятиях спортом, отказе от алкоголя, исключении профессиональных вредностей, полноценном питании, обязательной санации очагов инфекции. Рекомендуются повторные медикаментозные курсы кардиотрофной терапии 2–3 раза в год.
Изменение миокарда
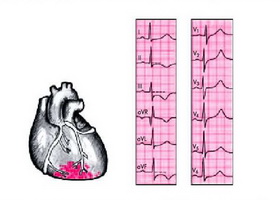
Электрокардиография является самым простым диагностическим методом исследования работы сердца. Суть обследования заключается в фиксации электрических импульсов, которые сопровождают сократительную и восстановительную функции миокарда, именуемых «деполяризация» и «реполяризация».
Что значит изменения миокарда на ЭКГ?
Специфические отклонения на электрокардиограмме могут быть зафиксированы при плановом медицинском осмотре, и характеризуют состояние миокарда на момент обследования. Функция миокарда заключается в синтезе кардиомиоцитами механической энергии, благодаря которой происходит сокращение полости и обеспечение нормального кровоснабжения всего организма. Этот процесс осуществляется за счёт клеточного обмена ионов натрия и калия в клетке. Работа проводящей системы сердца регистрируется на электрокардиограмме посредством зафиксированных на конечностях и грудной клетке электродов.
Патогенез
Изменения на ЭКГ это не заболевание, а лишь проявление каких-то патологических процессов, происходящих в миокарде. При сдвигах биохимической активности в клетках сердца меняется их сократительная способность, что отражается на кардиограмме при регистрации проведения импульсов. Функция кардиомиоцита может нарушаться при воспалительных процессах, например, при миокардитах. Приём некоторых лекарственных средств также отражается на работе сердечной мышцы.
Длительное течение сахарного диабета может постепенно привести к атеросклерозу. Поражаются не только крупные сосуды, но и коронарные артерии, которые питают миокард. При воспалительной патологии в ЖКТ нарушается всасываемость питательных веществ, что также негативно сказывается на обменных процессах в кардиомиоцитах.
Классификация
В зависимости от размеров и расположения изменённых кардиомиоцитов, выделяют:
- Диффузные изменения. Такое распространённое поражение свидетельствует о наличии множественных очагов изменённых кардиомиоцитов. Характерные признаки присутствуют во всех отведениях на ЭКГ.
- Очаговые изменения. Поражения регистрируются только в определённых отведениях, которые соответствуют конкретным участкам миокарда. Очаговые изменения это своего рода четко ограниченные участки соединительной, рубцовой ткани, которая инертна к проведению электричества.
При диагностике изменений на ЭКГ врач функциональной диагностики и врач-кардиолог может констатировать:
- раннюю желудочковую реполяризацию, которая проявляется отрицательным зубцом «Т»;
- снижение вольтажа зубца r, что характеризует сократительную способность миокарда;
- нарушения ритма;
- нарушения проводимости.
В зависимости от этих показателей определяют причины изменений на ЭКГ по характеру:
- воспалительные;
- рубцовые;
- дистрофические;
- метаболические.
Причины
Дистрофические изменения миокарда
Такие изменения на ЭКГ формируются при недостаточном питании кардиомиоцитов, что неизбежно ведёт к снижению сократительной способности левого желудочка. Диффузно-дистрофические изменения в миокарде наблюдается при:
- патологии эндокринной системы: сахарный диабет, дисфункция надпочечников, нарушения в работе щитовидной железы;
- патологии почечной системы и печени: избыточное количество токсических продуктов обмена негативно влияет на работу сердца;
- хронически протекающих заболеваниях инфекционного генеза: изменения могут наблюдаться при туберкулёзе, гриппе, малярии и т.д.;
- хронической железодефицитной анемии: постоянное кислородное голодание сказывается на работе кардиомиоцитов;
- при несбелансированном питании, при витаминодефиците в рационе;
- при чрезмерных нервных и физических перегрузках;
- при лихорадке и сопутствующем обезвоживании;
- при отравлении алкоголем, медикаментами либо химическими компонентами.
Метаболические изменения в миокарде
Что это такое? Характерные неспецифические изменения на ЭКГ формируются в результате нарушений внутриклеточных обменных процессов, связанных с ионами калия и натрия.
Метаболические изменения связаны с дистрофией сердечной мышцы и проявляются при:
-
миокарда, которая отражается на кардиограмме в виде отклонений зубца Т. Меняется его полярность и форма в соответствующих повреждённых участкам отведениях; : на ЭКГ меняется расположение сегмента ST, которые располагается либо выше, либо ниже изолинии;
- отмирании, некрозе миокарда, для которого свойственно появление аномального зубца Q.
Рубцовые изменения
Участки рубцовой ткани формируются на месте бывшего воспалительного процесса, некроза, в результате которого нормальные, здоровые кардиомиоциты потеряли свою сократительную способность, и произошло их замещение соединительной тканью, которая не обладает эластичностью. Рубцовые изменения очагового характера на ЭКГ говорят о перенесённом в прошлом инфаркте миокарда.
- Для нижней стенки левого желудочка характерны изменения в отведениях: II, III и a VF (говорит о повреждении правой, реже левой огибающей коронарной артерии).
- Для передне перегородочной области характерны изменения в отведениях: V1 и V2 (повреждена левая нисходящая септальная ветвь), либо V2-V4 (вовлечена левая нисходящая коронарная артерия, либо её ветви).
- Для переднее-латеральной области характерны изменения в отведениях: I, aVL, V4-V6 (повреждена огибающая артерия либо левая нисходящая).
- Для переднего распространённого инфаркта характерны изменения в отведениях: I, aVL, V1-V6 (повреждена левая нисходящая коронарная ветвь).
Умеренные изменения миокарда воспалительного характера
Характерные изменения наблюдаются при миокардите, при котором снижается вольтаж зубцов во всех отведениях, и регистрируются нарушения ритма. Умеренные изменения левого желудочка могут возникнуть после:
Бурая атрофия миокарда
Так называют макропрепарат при гистологическом исследовании. Характерные патологические изменения в миокарде формируются в результате длительного недостатка кровоснабжения, что наблюдается при истощающих заболеваниях, кахексии, злоупотреблении лекарственными препаратами, повышенных физических нагрузках, а также в старости. В кардиомиоцитах происходит отложение специфического пигмента старения – липофусцина. Его гранулы являются продуктом нарушенного метаболизма в клетках сердечной мышцы, ослабленных недостаточным питанием и кровоснабжением.
Симптомы
Умеренные и незначительные изменения на ЭКГ могут никак клинически себя не проявлять и быть находкой на кардиограмме при проведении плановых медосмотров и диспансеризации. При выраженных изменениях проявляется особая симптоматика:
- загрудинные боли давящего, жгучего характера, свидетельствующие о приступе стенокардии;
- отёчность нижних конечностей, одышка при минимальной физической нагрузке говорят о прогрессировании сердечной недостаточности;
- ощущение перебоев в работе сердца, аритмии;
- быстрая утомляемость, бледность кожных покровов;
- липкий пот; рук, потеря веса в короткие сроки.
Анализы и диагностика
Для выявления истинной причины изменений в миокарде рекомендуется пройти полное обследование, которое включает:
- Общий анализ и биохимический анализ крови. По результатам можно будет говорить о наличии воспалительного процесса в организме, работе почечной системы и почек, уровне холестерина, который формирует бляшки в коронарных артериях.
- ЭКГ. Характерные изменения при проведении обследования позволяют определиться с дальнейшей тактикой обследования. В некоторых случаях рекомендуется провести ЭКГ с нагрузкой, либо организовать суточный мониторинг ЭКГ.
- ЭхоКГ. Ультразвуковое исследование сердца позволяет оценить состояние клапанного аппарата сердца, выявить зоны повреждения, оценить насосную функцию сердца.
- Сцинтиграфия миокарда. Радиоизотопный метод исследования показывает участки накопления специального вещества для выявления участков поражения, определения их характера.
Изменения миокарда на ЭКГ позволяют определиться с дальнейшей тактикой обследования пациента для установки точного диагноза и подбора правильной терапии.
Лечение
При выявлении острого коронарного синдрома на ЭКГ, который свидетельствует об остром поражении миокарда в результате некроза мышцы, пациента экстренно госпитализируют в кардиологическое отделение с возможностью проведения коронароангиографии и определения дальнейшей тактики лечения.
При выявлении диффузных и дистрофических изменений проводится лечение основного заболевания, которое их могло спровоцировать. Дополнительно проводится метаболическая терапия, направленная на улучшение питания миокарда для его скорейшее восстановление.


