Антимикробные средства. Классификация антимикробных препаратов
По спектру активности антимикробные препараты делятся на: антибактериальные, антигрибковые и антипротозойные. Кроме того, все антимикробные средства делят на препараты узкого и широкого спектра действия.
К препаратам узкого спектра действия преимущественно на грамположительные микроорганизмы относятся, например, природные пенициллины, макролиды, линкомицин, фузидин, оксациллин, ванкомицин, цефалоспорины I поколения. К препаратам узкого спектра действия преимущественно на грамотрицательные палочки относятся полимиксины и монобактамы. К препаратам широкого спектра действия относятся тетрациклины, левомицетин, аминогликозиды, большинство полусинтетических пенициллинов, цефалоспорины начиная со 2 поколения, карбопенемы, фторхинолоны. Узкий спектр имеют антигрибковые препараты нистатин и леворин (только против кандиды), а широкий – клотримазол, миконазол, амфотерицин В.
По типу взаимодействия с микробной клеткой антимикробные препараты делятся на:
· бактерицидные – необратимо нарушают функции микробной клетки либо ее целостность, вызывая немедленную гибель микроорганизма, применяются при тяжелых инфекциях и у ослабленных больных,
· бактериостатические – обратимо блокируют репликацию или деление клетки, применяются при нетяжелых инфекциях у неослабленных больных.
По кислотоустойчивости антимикробные препараты классифицируются на:
· кислотоустойчивые – могут применяться перорально, например, феноксиметилпенициллин,
· кислотонеустойчивые – предназначены только для парентерального применения, например, бензилпенициллин.
В настоящее время используются следующие основные группы антимикробных препаратов для системного применения.
¨ Лактамные антибиотики
Лактамные антибиотики (табл. 9.2) из всех антимикробных препаратов наименее токсичны, так как, нарушая синтез клеточной стенки бактерий, не имеют мишени в организме человека. Их применение при наличии чувствительности к ним возбудителей является предпочтительным. Наиболее широкий спектр действия среди лактамных антибиотиков имеют карбапенемы, они используются как препараты резерва – только при инфекциях, резистентных к пенициллинам и цефалоспоринам, а также при госпитальных и полимикробных инфекциях.
¨ Антибиотики других групп
Антибиотики других групп (табл. 9.3) имеют различные механизмы действия. Бактериостатические препараты нарушают этапы синтеза белка на рибосомах, бактерицидные – нарушают либо целостность цитоплазматической мембраны, либо процесс синтеза ДНК и РНК. В любом случае они имеют мишень в организме человека, поэтому по сравнению с лактамными препаратами более токсичны, и должны использоваться только при невозможности применения последних.
¨ Синтетические антибактериальные препараты
Синтетические антибактериальные препараты (табл. 9.4) также имеют различные механизмы действия: ингибирование ДНК-гиразы, нарушение включения ПАБК в ДГФК и т.д. Также рекомендуются к применению при невозможности использования лактамных антибиотиков.
¨ Побочные эффекты антимикробных препаратов,
их профилактика и лечение
Антимикробные препараты обладают целым рядом разнообразных побочных эффектов, некоторые из которых могут привести к тяжелым осложнениям и даже к летальному исходу.
Аллергические реакции
Аллергические реакции могут иметь место при применении любого антимикробного препарата. Могут развиться аллергический дерматит, бронхоспазм, ринит, артрит, отек Квинке, анафилактический шок, васкулит, нефрит, волчаночноподобный синдром. Чаще всего они наблюдаются при применении пенициллинов и сульфаниламидов. У некоторых пациентов развивается перекрестная аллергия на пенициллины и цефалоспорины. Зачастую отмечаются аллергии на ванкомицин и сульфаниламиды. Очень редко дают аллергические реакции аминогликозиды и левомицетин.
Профилактике способствует тщательный сбор аллергологического анамнеза. Если пациент не может указать, на какие именно антибактериальные препараты в у него наблюдались аллергические реакции, перед введением антибиотиков необходимо выполнение проб. Развитие аллергии независимо от тяжести реакции требует немедленной отмены вызвавшего ее препарата. В последующем введение даже сходных по химической структуре антибиотиков (например, цефалоспоринов при аллергии на пенициллин) допускается только в случаях крайней необходимости. Лечение инфекции должно быть продолжено препаратами других групп. При тяжелых аллергических реакциях требуется внутривенное введение преднизолона и симпатомиметиков, инфузионная терапия. В нетяжелых случаях назначаются антигистаминные препараты.
Раздражающее действие на путях введения
При пероральном применении раздражающее действие может выражаться в диспепсических явлениях, при внутривенном введении – в развитии флебитов. Тромбофлебиты чаще всего вызывают цефалоспорины и гликопептиды.
Суперинфекция, в том числе дисбактериоз
Вероятность дисбактериоза зависит от широты спектра действия препарата. Наиболее часто возникающий кандидомикоз развивается при применении препаратов узкого спектра через неделю, при применении препаратов широкого спектра – уже от одной таблетки. Однако цефалоспорины относительно редко дают грибковую суперинфекцию. На 1 месте по частоте и тяжести вызываемого дисбактериоза находится линкомицин. Нарушения флоры при его применении могут принять характер псевдомембранозного колита – тяжелого заболевания кишечника, вызываемого клостридиями, сопровождающегося диареей, дегидратацией, электролитными нарушениями, и в отдельных случаях осложняющегося перфорацией толстой кишки. Гликопептиды тоже могут вызвать псевдомембранозный колит. Часто вызывают дисбактериоз тетрациклины, фторхинолоны, левомицетин.
Дисбактериоз требует отмены применявшегося препарата и длительного лечения эубиотиками после предварительной антимикробной терапии, которая проводится по результатам чувствительности микроорганизма, вызвавшего воспалительный процесс в кишечнике. Применяемые для лечения дисбактериоза антибиотики не должны оказывать влияния на нормальную кишечную аутофлору – бифидо- и лактобактерии. Однако при лечении псевдомембранозного колита используется метронидазол или, как альтернатива, ванкомицин. Необходима также коррекция водно-электролитных нарушений.
Нарушение толерантности к алкоголю – свойственно всем лактамным антибиотикам, метронидазолу, левомицетину. Проявляется появлением при одновременном употреблении алкоголя тошноты, рвоты, головокружения, тремора, потливости и падения артериального давления. Пациенты должны быть предупреждены о недопустимости приема алкоголя на весь период лечения антимикробным препаратом.
Органоспецифичные побочные эффекты для различных групп препаратов:
· Поражение системы крови и кроветворения – присущи левомицетину, реже линкосомидам, цефалоспоринам 1 поколения, сульфаниламидам, производным нитрофурана, фторхинолонам, гликопептидам. Проявляется апластической анемией, лейкопенией, тромбицитопенией. Необходима отмена препарата, в тяжелых случаях заместительная терапия. Геморрагический синдром может развиться при применении цефалоспоринов 2-3 поколения, нарушающих всасывание витамина К в кишечнике, антисинегнойных пенициллинов, нарушающих функции тромбоцитов, метронидазола, вытесняющего кумариновые антикоагулянты из связей с альбумином. Для лечения и профилактики используются препараты витамина К.
· Поражение печени – присущи тетрациклинам, которые блокируют ферментную систему гепатоцитов, а также оксациллину, азтреонаму, линкозаминам и сульфаниламидам. Холестаз и холестатический гепатит могут вызвать макролиды, цефтриаксон. Клиническими проявлениями служит повышение печеночных ферментов и билирубина в сыворотке крови. При необходимости применения гепатотоксических антимикробных средств более недели необходим лабораторный контроль перечисленных показателей. В случае повышения АСТ, АЛТ, билирубина, щелочной фосфатазы или глутамилтранспептидазы лечение должно быть продолжено препаратами других групп.
· Поражение костей и зубов характерны для тетрациклинов, растущих хрящей – для фторхинолонов.
· Поражение почек присуще аминогликозидам и полимиксинам, которые нарушают функции канальцев, сульфаниламидам, вызывающим кристаллурию, цефалоспоринам поколения, вызывающим альбуминурию, и ванкомицину. Предрасполагающими факторами являются старческий возраст, заболевания почек, гиповолемия и гипотензия. Поэтому при лечении данными препаратами необходима предварительная коррекция гиповолемии, контроль диуреза, подбор доз с учетом функции почек и массы ткла, Курс лечения должен быть коротким.
· Миокардит – побочный эффект левомицетина.
· Диспепсия, не являющаяся следствием дисбактериоза, характерна при применении макролидов, которые обладают прокинетическими свойствами.
· Различные поражения ЦНС развиваются от многих антимикробных препаратов. Наблюдаются:
– психозы при лечении левомицетином,
– парезы и периферические параличи при применении аминогликозидов и полимиксинов за счет их курареподобного действия (поэтому их нельзя применять одновременно с миорелаксантами),
– головная боль и центральная рвота при использовании сульфаниламидов и нитрофуранов,
– судороги и галлюцинации при использовании аминопенициллинов и цефалоспоринов в высоких дозах, являющиеся результатом антагонизма этих препаратов с ГАМК,
– судороги при применении имипенема,
– возбуждение при использовании фторхинолонов,
– менингизм при лечении тетрациклинами из-за увеличения ими продукции ликвора,
– нарушения зрения при лечении азтреонамом и левомицетином,
– периферическая нейропатия при применении изониазида, метронидазола, левомицетина.
· Поражение слуха и вестибулярные расстройства – побочный эффект аминогликозидов, более свойственный 1 поколению. Так как данный эффект связан с накоплением препаратов, длительность их применения не должна превышать 7 дней. Дополнительными факторами риска являются старческий возраст, почечная недостаточность и одновременное применение петлевых диуретиков. Обратимые изменения слуха вызывает ванкомицин. При появлении жалоб на снижение слуха, головокружение, тошноту, неустойчивость при ходьбе необходима замена антибиотика на препараты других групп.
· Поражения кожи в виде дерматита характерны для левомицетина. Тетрациклины и фторхинолоны вызывают фотосенсибилизацию. При лечении этими препаратами не назначаются физиотерапевтические процедуры, и следует избегать нахождения на солнце.
· Гипофункцию щитовидной железы вызывают сульфаниламиды.
· Тератогенность присуща тетрациклинам, фторхинолонам, сульфаниламидам.
· Возможен паралич дыхательной мускулатуры при быстром внутривенном введении линкомицина и кардиодепрессия при быстром внутривенном введении тетрациклинов.
· Электролитные нарушения вызывают антисинегнойные пенициллины. Особо опасно развитие гипокалиемии при наличии заболеваний сердечно-сосудистой системы. При назначении данных препаратов необходим контроль ЭКГ и электролитов крови. При лечении используют инфузионно-корригирующую терапию и диуретики.
Микробиологическая диагностика
Эффективность микробиологической диагностики, абсолютно необходимой для рационального подбора антимикробной терапии, зависит от соблюдения правил забора, транспортировки и хранения исследуемого материала. Правила забора биологического материала включают:
– взятие материала из области, максимально приближенной к очагу инфекции,
– предотвращение контаминации другой микрофлорой.
Транспортировка материала должна с одной стороны обеспечить жизнеспособность бактерий, а с другой – предотвратить их размножение. Желательно, чтобы материал хранился до начала исследования при комнатной температуре и не более 2 часов. В настоящее время для забора и транспортировки материала используются специальные плотно закрывающиеся стерильные контейнеры и транспортные среды.
В не меньшей степени эффективность микробиологической диагностики зависит от грамотной интерпретации результатов. Считается, что выделение патогенных микроорганизмов даже в малых количествах всегда позволяет отнести их к истинным возбудителям заболевания. Условно патогенный микроорганизм считают возбудителем, если он выделяется из стерильных в норме сред организма или в большом количестве из сред, не характерных для его обитания. В противном случае он является представителем нормальной аутофлоры либо контаминирует исследуемый материал в процессе забора или исследования. Выделение малопатогенных бактерий из нехарактерных для их обитания областей в умеренных количествах свидетельствует о транслокации микроорганизмов, однако не позволяет отнести их к истинным возбудителям заболевания.
Гораздо сложнее бывает интерпретировать результаты микробиологического исследования при высевании нескольких видов микроорганизмов. В таких случаях ориентируются на количественное соотношение потенциальных возбудителей. Чаще значимыми в этиологии данного заболевания бывают 1-2 из них. Следует иметь в виду, что вероятность равной этиологической значимости более чем 3 различных видов микроорганизмов незначительна.
В основе лабораторных тестов на выработку грамотрицательными микроорганизмами БЛРС лежит чувствительность БЛРС к ингибиторам бета-лактамаз, таким как клавулановая кислота, сульбактам и тазобактам. При этом, если микроорганизм семейства энтеробактерий оказывается резистентен к цефалоспоринам 3 поколения, а при добавлении к этим препаратам ингибиторов бета-лактамаз демонстрирует чувствительность, то данный штамм идентифицируется как БЛРС-продуцирующий.
Антибиотикотерапия должна быть направлена только на истинный возбудитель инфекции! Однако в большинстве стационаров микробиологические лаборатории не могут установить этиологию инфекции и чувствительность возбудителей к антимикробным препаратам в день поступления больного, поэтому неизбежным является первичное эмпирическое назначение антибиотиков. При этом учитываются особенности этиологии инфекций различных локализаций, характерные для данного лечебного учреждения. В связи с чем необходимы регулярные микробиологические исследования структуры инфекционных заболеваний и чувствительности их возбудителей к антибактериальным препаратам в каждом стационаре. Анализ результатов такого микробиологического мониторинга необходимо проводить ежемесячно.
Фармакология антибиотиков .
Эта глава направлена на то, чтобы в дальнейшем мы могли говорить на одном языке и понимать друг друга.
Автор: Трубачева Е.С., врач – клинический фармаколог
Итак, «Азбука Антибиотиков». Почему «Азбука»? Потому что любое новое направление изучения чего-либо должно начинаться с самых азов. Публикаций по антибактериальной терапии великое множество, книг не меньше, только есть одна маленькая загвоздка – все они предназначены, что называется, для продвинутого пользователя. Вопрос в том, как этим продвинутым стать. Мы решили попытаться решить эту задачу, и поэтому данный цикл не будет содержать ни науки, ни даже наукообразия. Здесь в максимально доступной, а где-то даже в просторечной форме, просто об очень сложном, будет публиковаться материал, без которого постижение антибактериальной терапии становится очень трудоемкой и времязатратной задачей, а то и вовсе вырождается в тоску зеленую. Вот эту самую трудность мы и попытаемся снять, чтобы в дальнейшем было легко ориентироваться в том, что написано для продвинутых пользователей.
Почему «Антибиотиков»? Безусловно, правильно говорить «антимикробный препарат» и «антимикробная терапия». Во-первых, потому что антибиотик – это «антижизнь», и тогда куда девать бактериостатики, которые лишь подавляют размножение? В микробиологические контрацептивы относить? Во-вторых, истинные антибиотики – это то, что природа сама насинтезировала в процессе эволюции в течение даже не веков, а тысячелетий – пенициллин, например. Думать о том, что микромир примитивен – это крайне наивное заблуждение. У микробов формируются целые сообщества (классический пример – биопленка), внутри которых ведется бурная социальная, да, я не оговорилась, именно социальная жизнь. Члены сообщества обмениваются информацией, осуществляют горизонтальный перенос факторов устойчивости, кого-то геноцидят, а кого-то холят и лелеют, как своеобразный back up, на случай гибели популяции. Кроме того, там постоянно ведется борьба за «место под солнцем», и одни популяции тиранят другие, вплоть до межвидовых сражений на уничтожение одних другими. А чем удобнее всего сражаться? Правильно – применением антибиотиков. Или подавлять размножение ненужной популяции в рамках одного сообщества бактериостатиками – именно по этому принципу дикие формы уничтожают антибиотикорезистентные – вторые банально не выдерживают накала внутривидовой борьбы. Все остальное, людьми сочиненное и синтезированное – это антимикробные препараты, перекрывающие весь возможный на данный момент спектр возбудителей и обладающие как бактерицидным, так и бактериостатическим действием. Но как дань традиции и, скажем честно, просто привычке, в медицинской среде всю антимикробную терапию привычно обзывают антибиотиками, и кто мы такие, чтобы эту самую традицию менять. Поэтому все, что будет написано далее, будет называться антибиотиками и антибиотикотерапией (АБТ), подразумевая под собой исключительно антимикробность существующего.
Как будет строиться наш цикл? Во-первых, от простого к более сложному, во-вторых, по алфавиту, для простоты навигации. И сегодня мы поговорим о первой букве алфавита А – «азах».
А – «Азы»
Эта глава направлена на то, чтобы в дальнейшем мы могли говорить на одном языке и понимать друг друга. Что-то объяснено подробно, а что-то пока надо принять за аксиому, так как объяснения займут объем, намного превосходящий данную статью. Мы поговорим и об этом, но чуть позже.
1. С какими возбудителями инфекций мы имеем дело в повседневной практике?
В 95% случаев это будет дикая, непуганая микрофлора, ни разу не встретившая на своем пути сделанный человечеством антибиотик. Таких возбудителей мы будем называть дикими (пару раз в литературе встречалось название «наивные», но оно не прижилось, ибо где, например Yersinia pestis (возбудитель чумы), а где наивность?).
Все, что будет написано в дальнейшем, будет касаться дикой микрофлоры, если не будет указано иное.
2. Что мы понимаем под антимикробной активностью препарата.
Казалось бы, вопрос очень простой – открываем аннотацию к любому антибиотику, и там все подробно написано. Но все не так просто.
Как определяется антимикробная активность? Правильно – в чашке Петри, на которой в присутствии дисков с антимикробными препаратами (или в жидкой питательной среде с разными концентрациями антибиотиков) засевают изучаемую культуру и смотрят, вырастет ли она вообще (тогда говорят о чувствительности к данному препарату), а если вырастет, то в каком количестве (те самые пресловутые один, два или три креста), в результате чего микроб будет объявлен умеренно чувствительным или полностью резистентным. В более продвинутых случаях детекцию антибиотикочувствительности проводят в автоматических анализаторах с определением минимальных подавляющих концентраций возбудителя (MIC или МПК возбудителя). И в этом кроется главная заковыка – все эти чашки и анализаторы не являются живым человеком, а мы даже близко не чашки Петри. В организме имеется великое множество ферментных систем и естественных барьеров, за которые умеют прятаться возбудители и куда не могут пробиться антибиотики. Кроме того, в чашке и анализаторе можно создать совершенно убийственную для микроба среду, а если то же самое повторить с пациентом, пациент может кончиться намного быстрее, чем кончится микроб (об этом мы поговорим в главе «Безопасность»). Давайте примем за аксиому, что то, что написано в аннотации, – это то, что произошло исключительно в чашках и анализаторах, но чаще всего не имеет никакой клинической значимости, то есть по описанному в аннотации антимикробному спектру ориентироваться нельзя, нужна клиническая эффективность.
Кроме того, достаточно регулярно появляются публикации о том, что какой-то пытливый ум провел очередной эксперимент с каким-нибудь НПВС или антиконвульсантом, или еще чем-нибудь совершенно не антимикробным: замешав его в питательную среду, попытался вырастить какой-нибудь микроб, и тот не вырос. И так мы получаем очередную «сенсацию». А сенсация ли это? Конечно, нет. Напомню еще раз – человек не чашка Петри, а главной целью антимикробного препарата является микроб, а никак не человек. А теперь представьте, какую концентрацию того же НПВС в теле человека надо будет создать, чтобы некоторое количество микробной популяции хотя бы придавить. И что будет с тушкой этого человека после этого, так как первоначальная точка приложения данной группы препаратов отнюдь не патогенная флора, не говоря уж о том, что и спектр действия подобной «терапии» совершенно неясен. Что-то упорно подсказывает, что на фоне подобных экспериментов опыты доктора Менгеле покажутся детским лепетом.
Так на что же мы должны ориентироваться в определении антимикробной активности? Как мы уже договорились выше, говорить будем в основном о дикой микрофлоре, и для нее антимикробная активность является табличным справочным материалом, который можно использовать в качестве шпаргалки на первых порах освоения вопроса. Где же взять эти таблицы? Для начала – это любой качественный справочник по антимикробной терапии с соответствующей вкладкой. Причем любой за последние 10-15 лет, так как принципиально в антимикробных спектрах дикой флоры ничего не поменялось, а введенные в практику новые антибиотики – это препараты настолько глубокого резерва, что без специальных знаний их не то, что использовать, трогать нельзя. Вопросы безопасности АБТ мы обсудим отдельно в соответствующей главе.
Какие справочники мы могли бы посоветовать? Во-первых, это издания Смоленского НИИ антимикробной химиотрерапии, которые каждый год реализуются в рамках Конгресса МАКМАХ в Москве в мае. Во-вторых, это в том числе переведенные на русский язык Сэнфордские справочники антимикробной терапии и, отдельно для педиатров, – «Антимикробная терапия у детей по Нельсону». Все они карманного формата и помимо антимикробных спектров содержат огромное количество полезной и необходимой для работы информации. Если вы владеете английским на уровне чтения технической литературы, перед вами раскроются такие источники как справочник по антимикробной терапии Хопкинса (отдельные материалы доступны по этой ссылке) и оригинальный Сэнфорд, которые можно установить в свои гаджеты.
3. Каких возбудителей мы будем истреблять?
В обязательном порядке всех абсолютных патогенов (возбудителей чумы, малярии, тифа и далее по списку). Этих представителей микромира в норме в человеке быть не может. А если они есть, да не просто на коже (тогда бы вымерли все хирурги, АиРы и дерматовенерологи), а во внутренних средах организма – это патоген в 95% случаев. Оставшиеся 5% оставим ацинеткам и синегнойкам на так называемую контаминацию/колонизацию, не вызывающую заболевания, но такие состояния надо уметь отличать от истинного заболевания.
Кроме того, меры высшей социальной защиты применяем по отношению к так называемым условным патогенам, то есть тем микробам, которые в местах своего естественного обитания являются нормальными жителями (например, кишечная палочка в кишке выполняет множество полезных функций, начиная с синтеза витамина К), но стоит им выбраться из этой среды туда куда не надо – тут же начинаются грандиозные проблемы (та же E.coli, влетевшая в легкие в процессе аспирации, вызывает тяжелую пневмонию, а попав в мочевыводящие пути не менее тяжелый пиелонефрит).
Для того чтобы понимать, в какой локации какой микроб норма, а какой уже патология, необходимо знать микробиологию на достаточно высоком уровне, чем мы и будем заниматься в дальнейших главах нашего проекта, а именно постигать АБТ через призму микробиологии, а не банальное перечисление групп препаратов и отдельных их представителей (согласитесь, подобных описаний и так в достатке). Но так как для этого потребуется время, а работать надо здесь и сейчас, то вам помогут вышеуказанные справочники, которые содержат главы «Антибиотикотерапия в зависимости от локализации инфекции», где указываются патогенные микробы для конкретных сред и локаций организма, как уже упомянутая E.coli в бронхоальвеолярном лаваже.
4. Виды антимикробной терапии
Эмпирическую терапию мы используем ежедневно, назначая антибактериальные препараты и не зная наверняка, какой именно возбудитель вызвал заболевание, но предполагая совершенно определенный спектр возбудителей, вызывающих данную инфекцию в зависимости от жалоб, анамнеза и локализации оной. Так как пациента лечить надо сразу, так как при многих состояниях задержка с назначением адекватной терапии увеличивает летальность в 2-3 раза, не говоря о тяжести течения и осложнениях, то были разработаны соответствующие схемы эмпирической терапии. Это тоже является справочным материалом, и толковая книжка в кармане очень помогает решить проблему. Кроме того, в назначении эмпирической терапии может помочь микробиологическая лаборатория, даже в условиях минимального ее оснащения, просто покрасив мазок по Граму, что занимает максимум час с учетом доставки до места. Это поможет сориентироваться, грамположительный или грамотрицательный микроб вызвал текущую проблему (классический пример – покрасить мазок с патологически измененных миндалин и увидеть стрептококк), и назначить антимикробный препарат с соответствующим спектром активности. Еще одним видом помощников являются экспресс-тесты. Подробнее вопрос обсудим в главе по микробиологической диагностике.
Этиотропную терапию мы используем, когда микробиологическая лаборатория выдает результаты посева и чувствительности к антибиотикам и теперь уже почти точно известно, что вызвало заболевание. Почти – это не оговорка, лаборатория может выдать очень странный результат, и задача врача понимать, пришел ли действительно возбудитель, или контаминат, или вообще артефакт. А еще вопрос в том, как быстро лаборатория выдаст этот результат. Идеальной является ситуация, когда лаборатория оснащена системами автоматической детекции и результат выдается в течение максимум 48 часов, укладываясь в рамки сроков оценки эффективности АБТ и принятия последующих решений. Но чаще всего получается так, что пациент давно выписан или переведен в другое отделение, а результаты только-только прибыли, и в такой ситуации смотрим следующий пункт.
5. Критерии эффективности АБТ
– основываются на субъективном мнении врача и клинических критериях.
К клиническим критериям улучшения состояния относятся:
- Уменьшение ЧСС
- Нормализация нервно-психического статуса
- Уменьшение болевых ощущений
- Уменьшение напряжения брюшной стенки
- Возможность приема пищи
- Появление чувства голода
- Появление стула
- Восстановление диуреза
В зависимости от механизма действия препарата, мы используем либо «правило 48 часов», либо «правило 72 часов»
«Правило 48 часов» заключается в том, что мы оцениваем клинические результаты применения антибиотика не ранее, чем через 48 часов, а именно на 3-и сутки. Мы четко должны видеть положительную динамику в виде снижения температуры и интоксикации на фоне приема антибактериальных препаратов. Это правило используется при применении бактерицидных препаратов.
6. Критерии окончания АБТ
Общим правилом для прекращения приема антимикробных препаратов является наступление явного клинического улучшения, определяемого на основании субъективного мнения врача и объективных признаков, таких как:
Антибиотики
Антибиотики – это препараты, направленные на уничтожение живых болезнетворных бактерий, они вошли в нашу жизнь более полувека назад и прочно обосновались в ней.
Благодаря антибиотикам такие заболевания, как туберкулез, пневмония, гангрена и множество других бактериальных инфекций перестали быть смертельными для человека. Но даже самые сильнодействующие антибактериальные препараты не в силах справиться со всеми патогенными бактериями. Это связано с тем, что болезнетворные бактерии постоянно эволюционируют, вырабатывая природные генетические механизмы противостояния лекарственным препаратам. Число новых генераций микробов, «устойчивых» к даже самым сильным антибиотикам, с каждым годом неумолимо растет. Ученые всего мира постоянно находятся в поиске новых эффективных методов в борьбе с неуязвимыми бактериями.
История антибиотиков
Еще в древние времена в Китае, Индии, Египте и Греции для дезинфекции ран и гнойников применяли плесневелый хлеб и некоторые виды растений, упоминания о лекарственных свойствах плесени были еще в работах древних философов. В 1873 году была опубликована научная работа А.Г. Полотебнова «Патологическое значение зеленой плесени» о лечебном действии плесени на гнойные раны, которую он рекомендовал использовать ее в лечении кожных заболеваний. Но должного внимания в медицинских кругах эта работа так и не получила. Бартомелео Гозио медик и микробиолог в 1896 году выделил из плесневых грибов микофеноловую кислоту – первый в мире антибиотик, который был активен против бактерии – возбудителя сибирской язвы. В 1987 году французский военный врач Эрнест Дюшен опробовал плесневые грибы рода Penicillium на морских свинках и обнаружил, что плесень оказывает разрушающее действие на палочку брюшного тифа. Увы, его работа также не привлекла внимание среди научного сообщества.

Русский ученый М.Г. Тартаковский в 1904 году заявил, что вещества, которые вырабатываются зеленой плесенью, подавляют развитие возбудителя куриной холеры. Американские ученые Отис Фишер Блек и Карл Альсберг в 1913 году получили токсичное вещество из плесени рода Penicillium puberulum, которое, как позже выяснилось было пеницилловой кислотой, и обладало противомикробными свойствами. В 1928 году британский бактериолог Александр Флеминг проводил очередную работу, направленную на исследование защитных реакций человеческого организм на инфекционные заболевания, спровоцированные бактериями стафилококков. В процессе проведения опыта в одной из лабораторных чаш Флеминг обнаружил образование колоний плесневых грибов, попавших туда совершенно случайным образом. Он заметил, что вокруг колоний плесени нет стафилококковых бактерий. В ходе данного опыта ученый сделал вывод, что плесень выделяет вещество, уничтожающее патогенные бактерии и назвал его «пенициллином», так как он был выделен из грибов рода Penicillium notatum, о котором он доложил на заседании Медицинского исследовательского клуба при Лондонском университете 13 сентября 1929 года. Но и тогда работа Флеминга не вызвала большого энтузиазма среди медиков, поскольку пенициллин оказался неустойчивой субстанцией, которая быстро разрушалась даже при кратковременном хранении. Ученые немец Эрнст Борис Чейн и австралиец Говард Флори, работавшие в Англии в 30-е годы ХХ века вплотную занялись усовершенствованием эффективности пенициллина. В скором времени им удалось получить достаточное количество пенициллина в чистом виде и протестировать на лабораторных мышах. Данный тест показал очень высокую антибактериальную эффективность препарата. В связи с огромной смертностью солдат от гнойных ран во время Второй мировой войны потребность в действенных медикаментах была катастрофически большой. В 1943 году началось массовое производство пенициллина, благодаря данному лекарству были спасены сотни тысяч человеческих жизней во всем мире. И только в 1945 году Говард Флори, Александр Флеминг и Эрнст Борис Чейн получили Нобелевскую премию по медицине «За открытие пенициллина и его целебного воздействия при различных инфекционных болезнях». Вслед за пенициллином последовали открытия и других антибактериальных средств. В СССР первым антибактериальным медикаментом был «Крустозин», открытие которого принадлежит микробиологу Зинаиде Ермольевой в 1942 году. До 2017 года учеными во всем мире были произведены различные модификации препарата, вследствие появления резистентности бактерий к существующим лекарствам. В 2018 году учеными из Иллинойского университета были разработаны полусинтетические антибиотики нового класса. Данный препарат был создан на основе соединения диоксинибомицина и показал свою высокую эффективность против широкого спектра грамотрицательных бактерий. Антибиотик в переводе с греческого – «против жизни». В 1942 году данный термин предложил американский микробиолог Зельман Ваксман, с именем которого связано открытие другого антибактериального средства – стрептомицина, применяющегося и сегодня для лечения туберкулеза.
Источники антибиотиков
Основными источниками получения антибиотиков являются актиномицеты (продуцируют около 80% природных антибиотиков), плесневые грибы и типичные бактерии, но являются далеко не единственными. На сегодняшний день науке известно около 30 000 антибиотиков природного происхождения, но это вовсе не означает, что все существующие ныне антибиотики продуцированы живыми клетками. Ученые химики еще с 60-х годов научились существенно улучшать противомикробные свойства антибиотиков, произведенных природными микроорганизмами, модифицируя их химическими методами. Полученные таким образом препараты относятся к полусинтетическим антибиотикам. Из всего многообразия антибиотиков в медицинских целях используют всего около ста.
Способы получения антибиотиков
- Биологический синтез (культивация продуцентов и выделение ними антибиотиков в процессе своей жизнедеятельности)
- Боисинтез с химическими модификациями (полусинтетические антибиотики)
- Химический синтез (синтетические аналоги природных антибиотиков)
Классификация антибиотиков
- Бета-лактамы (пенициллины, цефалоспорины, карбапенемы, монобактамы)
- Гликопептиды (ванкомицин, тейкопланин)
- Аминогликозиды (стрептомицин, мономицин, канамицин, неомицин – I-го поколения; гентамицин и т.д. – II-го поколения)
- Тетрациклины
- Макролиды (и азалиды)
- Линкозамиды
- Левомицетин (хлорамфеникол)
- Рифамицины
- Полипептиды
- Полиены
- Разные антибиотики (фузидиевая кислота, фузафунжин и др.)
- Антибактериальные антибиотики (самая многочисленная группа препаратов):
- активные в отношении грамположительных микроорганизмов;
- широкого спектра действия – действуют одновременно на грамположительные и грамотрицательные бактерии;
- противотуберкулезные, противолепрозные, противосифилитические препараты;
- противогрибковые
- Противоопухолевые антибиотики
- Антипротозойные и противовирусные антибиотики
Как действуют антибиотики?
Главной задачей антибиотика, когда он попадает в организм, является присоединение к бактерии с целью ее уничтожить либо лишить возможности размножаться, вследствие чего она самостоятельно погибнет. Для этого у каждого антибиотика есть своя мишень, как правило, это белок, фермент или часть ДНК патогенного микроорганизма, и механизм воздействия на бактерию. Именно поэтому назначают те или иные антибактериальные препараты в зависимости от возбудителя заболевания. В медицинской практике применяют лекарственные препараты, которые прицельно бьют по мишеням, не затрагивая клетки нашего организма.
Лечение антибиотиками
Самостоятельно назначать себе прием антибиотиков нельзя, такое назначение может делать только доктор. Антибактериальные препараты применяют для предотвращения и лечения воспалительных процессов, вызванных патогенными бактериями. Лечение вирусных заболеваний, например, ОРВИ будет не эффективно.

Не следует сопровождать терапию антибиотиками другими лекарственными препаратами, способными повлиять на их действие, а также важно соблюдать равный интервал времени между приемами противомикробного средства и ни в коем случае не сочетать лечение с алкоголем. Не прекращайте прием антибиотиков, если вы почувствовали облегчение, курс лечения, назначенный квалифицированным специалистом, необходимо пройти в полном объеме. В случае если прием антибиотика не дает результата в течение 72 часов от начала лечения, необходимо обратиться к вашему лечащему врачу, с просьбой заменить назначенный препарат.
Лекция 10 ”Антибиотики.”
Принципы антибиотикотерапии. Побочное действие антибиотиков.
Антибиотики разных групп.
Антибиотики – стимуляторы роста.
Комбинированные препараты с антибиотиками.
Субботин В.М., Субботина С.Г., Александров И.Д. Современные лекарственные средства в ветеринарии. / Серия “Ветеринария и животноводство”, Ростов-на-Дону: “Феникс” , 2000. – 592 с.
Фармакология / В.Д. Соколов, М.И. Рабинович, Г.И. Горшков и др. Под. ред. В.Д. Соколова. – М. : Колос, 1997. – 543 с.
И.Е. Мозгов. Фармакология. – М. : Агропромиздат, 1985. – 445 с.
Д.К. Червяков, П.Д. Евдокимов, А.С. Вишкер. Лекарственные средства в ветеринарии. – М. : Колос, 1977. – 496 с.
Учебно-методическое пособие для самостоятельной работы студентиов по общей и частной фармакологии / Толкач Н.Г., Арестов И.Г. Голубицкая А.В., Жолнерович З.М. и др. – Витебск, 2000. -37 с.
Современные фармакологические средства и способы их применения: учебно-методическое пособие по частной фармакологии. /Толкач Н.Г., Арестов И.Г., Голубицкая А.В. и др. – Витебск 2001 г.- 64 с.
В.Ф. Ковалев, И.Б. Волков, Б.В. Виолин и др. Антибиотики, сульфаниламиды и нитрофураны в ветеринарии. – М. : Агропромиздат, 1988. – 223 с.
8. М.Д. Машковский. Лекарственные средства. М.: «Новая волна», 2005 – 1015 с.
9. Лекарственные средства в ветеринарии. Справочник. Ятусевич А.И., Толкач Н.Г., Ятусевич И.А. и др. Минск, 2006. –
Антибиотики (лекция 1)
Определение. Краткая история открытия.
Общая характеристика антибиотиков.
Принципы антибиотикотерапии. Побочное действие антибиотиков.
Определение. Краткая история открытия.
Антибиотики (от греч. anti- против, bios – жизнь) – биологически активные вещества, являющиеся продуктами жизнедеятельности различных организмов (грибов, бактерий, животных, растений) и обладающие способностью в чрезвычайно малых концентрациях избирательно подавлять (убивать) микро- паразитоорганизмы in vitro (в питательной среде) и in vivo (в организме больного).
Антибиотики – это химиотерапевтические вещества, образуемые микроорганизмами или полученные из иных природных источников, а также их производные и синтетические продукты, обладающие способностью избирательно подавлять в организме возбудителей заболевания или задерживать развитие злокачественных новообразований (Навашин, Фомина, 1982). Явление “антибиоза” – антогонизма между микроорганизмами описано Л. Пастером в 1877 году.
Понятие “антибиотик” впервые высказал в прошлом веке Вильемен, но термин “антибиотик” в современном понимании ввел Ваксман в 1943 г.
История целенаправленного поиска и использования антибиотических средств уходит в глубокую древность. Еще 3500 лет назад в Китае пользовались заплесневелым творогом, а позднее и хлебом для лечения различных гнойных ран.
Вплотную к открытию антибиотиков подошел Полотебнов, сообщивший в 1872 г о лечении гнойных ран порошком из плесени спор гриба пенициллиум. Однако эра антибиотиков и антибиотикотерапии связана с именем Флеминга, который в 1929 г. сообщил об антимикробном действии вещества, полученного им из плесени пенициллиум. Тем не менее потребовалось еще десятилетие, прежде чем пенициллин был внедрен в практику. С этим успешно справились Флори и Чейн, получившие впервые в 1940 г химически чистый пенициллин.
В бывшем СССР эту миссию выполнила Ермольева, которая выделила отечественные штаммы пенициллина и в 1942 г получила химически чистый пенициллин.
Начало применения в медицинской практике пенициллина открыло новую эру в лечении инфекционных болезней. Вслед за пенициллином быстро стали появляться другие антибиотики. Оказалось, что продуцентами антибиотиков являются не только плесневые грибы.
В 1943 г из лучистого гриба Streptomyces globisporus был выделен стрептомицин. Из Streptomyces Aureofaciens был выделен первый тетрациклиновый антибиотик ауреомицин (хлортетрациклин) и т. д.
В дальнейшем стали получать не только природные, но и полусинтетические антибиотики, меняя структуру природных антибиотиков, а отдельные антибиотики получать путем полного химического синтеза.
Непрерывно продолжается поиск и изучение новых антибиотиков, как продолжается совершенствование технологии их получения с использованием генной инженерии. В практике ветеринарной медицины изучением антибиотиков занимались . Евдокимов, Мозгов, Вильчинская, Субботин и др.
Фармакология антибиотиков .
Антибиотики представляют собой самую многочисленную группу лекарственных средств. Так, в России в настоящее время используется 30 различных групп антибиотиков, а число препаратов (без учета неоригинальных) приближается к 200. Польза антибиотиков является неоспоримым фактом. Важно то, что они приносят пользу и даже могут спасти человеческую жизнь только в том случае, когда лекарственные препараты и другие виды лечения не помогают. Антибиотики способны препятствовать развитию практически всех видов микробов. Доля антибиотиков на рынке лекарственных препаратов в разных странах составляет от 6 до 21%, при этом имеется четкая тенденция к увеличению использования препаратов данной группы. Риск появления побочных явлений и осложнений определенно есть. В нашей статье мы поднимаем одну из актуальных проблем, такую как ошибки при использовании антибиотикотерапии.

5. Т.Ф. Одегова, О.Г. Олешко, Н.В. Новикова. Микробиология. Учебник для фармацевтических ВУЗов. – Л.: Типография ГОУ ВПО ПГФА 2009-377с.
6. Л. С. Страчунский, С.Н. Козлов. Антибиотики: клиническая фармакология. – Смол.: Амипресс 1994-208 с.
В настоящее время под термином антибиотики понимают продукты жизнедеятельности любых живых организмов, обладающих высокой биологической активностью по отношению к определенным группам микроорганизмов или клеткам злокачественных опухолей, избирательно задерживающих рост или полностью подавляя развитие.
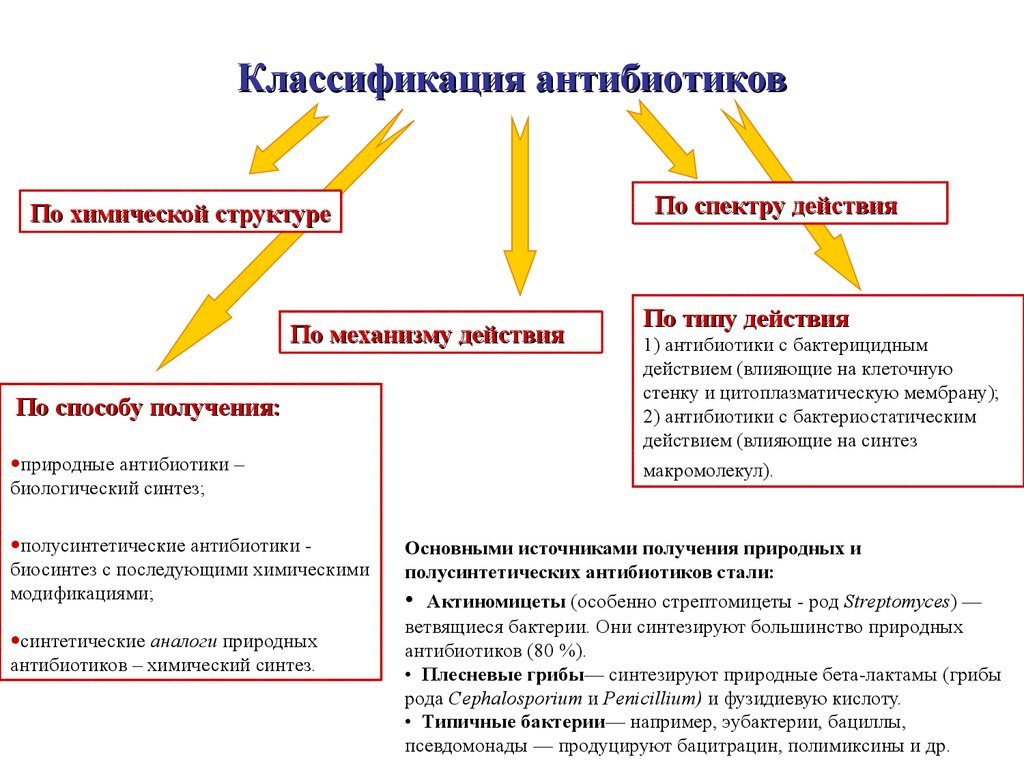
Современная классификация антибиотиков разработана в Государственном центре по антибиотикам (С.М.Навашин, 1994), в соответствии с которой они характеризуются по механизму действия, химической структуре, противомикробному спектру, типу действия на клетку.
По химическому строению антибиотики делятся на:
1.Бета-лактамные антибиотики – включают большую группу препаратов, общим для которых является наличие бета-лактамного кольца. В зависимости от строения второй части бициклического кольца, бета-лактамные антибиотики разделяются на пеницилины, цефалоспорины, каропенемы, монобактамы.
а) Пенициллины. Родоначальником пеницилинов является бензилпенициллин-антибиотик природного происхождения, продукт жизнедеятельности грибов рода Pennicillum. Основой химической структурой пенициллинов является 6-аминопенициллиновая кислота. Классические пенициллины –это препараты с преимущественной активностью в отношении грамположительных бактерий .Модификацией молекулы путем присоединения к ней разных радикалов в положении 6 удалость получить полусинтетические антибиотики с более широким спектром действия и благоприятной фармакокинетикой. Недостатки: узкий спектр действия, большая частота аллергический реакцией, быстро выводятся из организма(кроме бициллина),быстро формируется устойчивость микробов за счет образования бета-лактамаз-ферментов, разрушающих бета-лактамное кольцо.[1]
В связи с широким распространением резистентных к антибактериальным препаратам микробов, вызванных продукцией ими бета-лактамаз, были созданы препараты, получившие название ингибиторы «бета-лактамаз». Они имеют свойство необратимо инактивировать широкий спектр бета-лактамаз, продуцируемых различными микроорганизмами. К ним относят клавулановую кислоту, сульбактам, тазобактам.[3]
К препаратам содержащим пенициллины и ингибиторы бета-лактамаз-защищенным пенициллинам-относят сочетания ампициллин/сульбактам, амоксициллин/клавуалановая кислота, тикарциллин/клавулановая кислота, пиперациллин/тазбактам. Эти препараты применяются для лечения инфекции различных локализаций (дыхательные пути, мочевыделительная система, кожа и мягкие ткани, брюшная полость, малый таз и др.),особенно при высоком риске наличия возбудителя, продуцирующих бета-лактамазы.
Наиболее частые осложнения при приеме пенициллинов это аллергические реакции. Иногда это кожные высыпания, дерматиты, лихорадка. Более тяжелые случаи характеризуются отеком слизистых оболочек, артриты, поражение почек. Наиболее тяжелым является анафилактический шок. Иногда анафилактический шок может закончится летально.
б) Цефалоспорины. Имеют в своей основе 7-аминоцефалоспориновую кислоту . Выделяют четыре поколения цефалоспоринов.
Цефалоспорины 1 поколения(цефазолин,цефалексин) активны преимущественно в отношении грамположительных кокков(стафилококков,стрептококков и др.)и некоторых грамотрицательных бактерий.
Цефалоспорины 2поколения(цефуроксим,цефаклор) обладают более широким спектром действия по сравнению с препаратами 1 поколения за счет наличия активности в отношении грамотрицательных бактерий.
Цефалоспорины 3 поколения(цефотаксим,цефтриаксон) имеют более высокую активность в отношении различных грамотрицательных бактерий (энтеробактерии, гемофилуса, гонококков, менингокков ) по сравнению с цефалоспоринами 2 поколения. кроме того, некоторые цефалоспорины 3 поколения (цефтазиди) активны в отношении синегнойной палочки.
Цефалоспорины 4 поколения (цефепим,цефпиром)-химической особенностью данных препаратов является их биполярна структура, что обеспечивает быстрое проникновение молекулы через наружную мембрану бактерий. Цефалоспорины 4 поколения характеризуются более широким спектром антимикробной активности по сравнению с цефалоспоринами 3 поколения. Они высокоактивны как в отношении большинства грамотрицательных бактерий, в том числе продуцирующих бета-лактамазы, включая синегнойную палочку, так и отношении грамположительных бактерий.
Среди цефалоспоринов также существуют защищенные препараты, в частности цефоперазон/сульбактам. Этот лекарственный препарат представляет собой фиксированную комбинацию цефалоспоринов 3 поколения с ингибитором бета-лактамаз. Входящие в его состав препараты оказывают синергидное антимикробное действие на многие резистентные микроорганизмы. Препараты успешно применяются для лечения заболеваний дыхательных и мочевыводящих путей, хирургических и гинекологических инфекций.[4]
в)Карбапенемы (имипенем, меропенем) характеризуются наиболее широким спектром противомикробной активности среди всех бета-лактамных антибиотиков. Они в отношении грамположительных грамотрицательных аэробных бактерий ,анаэробов, более устойчивы к действию бета-лактамаз.
г)Монобактамы или моноциклические бета-лактамы, в клинической практике применяется один препарат-азтреонам, имеющий узкий спектр антибактериальной активности. Воздействует на аэробную грамотрицательную флору.
Бета-лактамные антибиотики применяются при инфекциях дыхательных путей, мочевыводящих путей, гнойных процессах различной локализации, внутрибольничных инфекциях.
2) Аминогликозиды. Среди этой группы выделяют препараты 3х поколений.
Аминогликозиды 1 поколения (стрептомицин, канамицин) в настоящие время применяются ограниченно, преимущественно во фтизиатрии.
Аминогликозиды 2 поколения (гентамицин, тобрамицин) и 3 поколения (амикацин) широко применяются в клинической практике.
Аминогликозиды обладают широким спектром противомикробной активности, но препараты слабо действуют на стрептакокки, не активны в отношении анаэробных бактерий. Эти антибиотики используются при лечении туберкулеза, инфекции дыхательных путей, септических состояний. Аминогликогзиды способны вызывать вестибулярные нарушения, нефротоксичность, нейромышечную блокаду и аллергические реакции [5]
3)Гликопептиды. К этой группе относятся природные антибиотики-ванкомицин и тейкопланин. Гликопептиды являются препаратами выбора при внутрибольничных инфекциях ,вызванных устойчивыми формами стафилококка ,энтерококка.
4) Липопептиды. Группа препаратов представлена, предложенным в последнее время антибиотиком даптомицином, который активен по отношению к грамположительным микробам, в том числе к устойчивым штаммам.
5)Макролиды. Это природные вещества или полусинтетические соединения, которые содержат 14,15 или 16-членное лактамное кольцо. Ранние макролиды активны, главным образом, по отношению к грамположительным и «атипичным» возбудителям ( хламидии, риккетсии, микоплазмы), обладают более высокой токсичностью (эритромицин ,рокситромицин). Новые макролидные антибиотики высокоактивны, реже вызывают побочные действия, более удобны в применении (кларитромицин, азатромицин). Эти антибиотики используются при лечении инфекций дыхательных путей, инфекций, передающихся половым путем.
6) Тетрациклины обладают широким спектром противомикробной активности. Наибольшее клиническое значение имеют тетрациклин и диксициклин, которые используются для лечения хламидиозов, риккетсиозов, некоторых зоонозов. Недостатки: гепатотоксичность, тератогенность, развитие резистентности бактерий, приобретенной в процессе их многолетнего использования. Антибиотики тетрациклинового ряда относительно малотоксичные препараты. Однако при длительном применение могу давай серьезные ослажнения. Накапливаясь в печени тетрациклины могу вызывать желтуху, гипопротромбинемию и нарушение свертываемости крови. Описаны тяжелые случаи некроза печени с летальным исходом . Способность тетрациклинов накапливаться в костях может привести к задержке роста костей в длину, нарушению развития зубов, окраска зубов в желто-коричневый вет и раннему кариесу у детй.
7) В группу линкозамидов входят природные антибиотики линкомицин и его полусинтетеческий аналог клиндамицин. Они активны по отношению г грамположительным бактериям, преимущественно к коккам. Используются в качестве препаратов резерва, когда неэффективны другие антибиотики.
8) Группа оксазолидинонов линезолид- первый представитель данного класса. Он проявляет высокую активность по отношению к грамположительным микроорганизмам( стафилококки, энерококки, превмококки). Также является препаратом резерва.
9) Группа полимиксинов характеризуется узким спектром активности и высокой токсичностью. Это соединения активны по отношению к грамотрицательным бактериям. Природной устойчивостью обладают грамотрицательные кокки и вся грамположительная флора. Препараты этой группы применяют при тяжелых инфекциях, вызванных синегнойной палочкой и резистентной грамотрицательной микрофлорой.
10) Группа левомицитина характеризуется широким спектром противомикробной активности, бактериостатическим действием. Недостатки: левомицитин угнетает кровообращение, у новорожденных вызывает «синдром серой асфиксии». В настоящее время имеет ограниченное применение, используется при бактериальном менингите, брюшном тифе. Левомицетин может нарушать зрение, слух, вызывать психические расстройства, а так же- вызывать аллергические реакции в виде сыпей на коже.
По спектру действия антибиотики делятся на:
1. Антибиотики узкого спектра действия (влияют преимущественно на грамположительные бактерии, например, пенициллин, эритромицин)
2. Антибиотки широкого спектра действия (угнетают рост грамположительных и грамотрицательных микроорганизмов, например, гентамицин, цефалоспорины 2-4 поколений)
3. Антибиотики со специфической активностью: противотуберкулезные, противогрипковые, антипротозойные, противоопухолевые)
Противомикробные препараты, или антимикотики, представляют собой обширный класс разнообразных химических соединений как природного происхождения, так и полученные синтетическим путем, которые обладают активностью в отношении патогенных грибов. В зависимости от их химической структуры они разделяются на несколько групп, отличающихся по спектру активности, фармакокинетике: полиены (нистатин, леворин, амфотерицин В), азолы (кетоконазол, флуконазол, итраконазол – для системного применения, клотримазол, миконазол – для местного применения), эхинокандины (каспофунгин), флюоропиримидины (флуцитозин), аллиламиды (тербинафин), препараты разных групп (гризеофульфин, аморолифин).
Говорить о принципах антибиотикотерапии –– это значит постулировать те вопросы, на которые должен обязательно ответить врач, когда выбирает лечебный препарат и его дозу.
Совершенно очевидно, что антимикробные препараты в разных клинических ситуациях не равноценны, одни полезны, а другие нет, одни опасны, другие безвредны, одни экономически целесообразны, другие недопустимо затратны. Вопросов много, но есть базовые, принципиальные, без ответа на которые антибиотикотерапии быть не может. Их многократно формулировали с разной степенью убедительности.[5]
Принципы рациональной антибиотикотерапии:
- Микробиологический: необходимо наличие показаний для использования антибиотиков; в терапии вирусных инфекций не целесообразно использовать антибиотики, обладающие способностью угнетать рост бактерий. Антибиотики необходимо назначать в соответствии с чувствительностью к ним конкретного возбудителя заболевания.
2. Фармакологический: назначение антибиотиков в соответствии с фармакокинетикой противомикробного средства. Препараты нужно назначать в такой дозе и вводить так часто, чтобы обеспечить его среднюю терапевтическую концентрацию в тканях и жидкостях макроорганизма на протяжении всего курса терапии. Путь введения определяется биодоступностью антибиотика, тяжестью заболевания, локализацией паталогического процесса. Применяется внутримышечное, внутривенное введение, per os, в виде ингаляций, местно (накожно, в виде глазных капель), per rectum, внутриполостное введение (в брюшную полость)
3. Клинический – выбор антибиотика, его дозы и способа введения производится с минимальным повреждающим действием препарата на макроорганизм. Следует определить переносимость антибиотика, учесть пол, возраст, сопутствующую патологию пациента.
4. Эпидемиологический: назначение антибактериального препарата с учетом устойчивости микроорганизма в среде, окружающей больного (в стационаре, географическом регионе).
5. Фармацевтический – назначение противомикробного средства с учетом соблюдений сроков годности и условий хранения.
6. Адекватное комбинирование. Необходимо правильно сочетать антибиотики разных групп с учетом их спектра и характера действия, побочных эффектов. Например, нельзя комбинировать пенициллины, оказывающих бактерицидное действие на клетку в фазе роста с тетрациклинами, задерживающих рост бактерий. Необходимо рационально сочетать антибиотики с другими лекарственными препаратами (пробиотиками, противогрибковыми средствами, витаминами).
7. Оценка эффективности действия антибиотиков: при проведении курса антибиотикотерапии оценивают динамику симптомов заболевания, динамику лабораторных и бактериологических показаний. Если в течении 2-3 дней отсутствует положительный эффект, следует отменить данный антибиотик и назначить другой.[5]
Сегодня в общественном сознании существует множество точек зрения, причем нередко взаимоисключающих друг друга, о том, что же такое антибиотики, когда и как их надо применять и насколько они опасны для человека. Предположение о том, что истина лежит где-то посередине между крайними точками зрения, вполне разумно, но нуждается в некоторой конкретизации. При длительном применении некоторые антибиотики могут оказывать токсическое действие на центральную нервную систему человека, подавлять его иммунитет, вызывать аллергические реакции. Однако по выраженности побочных явлений они не превосходят другие лекарственные средства.
Суммируя вышесказанное, необходимо подчеркнуть, что антибактериальные препараты являются важным, зачастую главным компонентом . Их рациональное и обоснованное применение в большинстве случаев определяет эффективность проводимого лечения.
Лучшее в 2020: Пероральные антибиотики: «сильные» и «слабые»
Ученые утверждают, что бактерии существуют на Земле 3,8х10 9 лет, в то время как антибиотики используют в клинической практике лишь с 40‑х годов прошлого века [1]. Но и этого времени хватило, чтобы препараты указанной группы обросли массой мифов, которые мешают эффективной антибиотикотерапии. Несмотря на то что лечение антимикробными средствами априори невозможно без непосредственного руководства врача, современный «пациент разумный», подверженный влиянию околонаучных данных, вносит свой «неоценимый вклад» в дело антибиотикорезистентности и прочих негативных последствий некорректного применения антибиотиков. Предостеречь его от опрометчивых решений могут грамотные фармацевтические специалисты, которые владеют корректной информацией об антимикробных средствах и готовы поделиться ею с клиентом.
Миф. Современные антибиотики настолько «сильные», что перед ними не устоит ни одна бактерия
Правда. На самом деле одной из самых актуальных проблем современной фармакологии и здравоохранения в целом является стремительное развитие резистентных штаммов бактерий, устойчивых в том числе и к современным антибиотикам последних поколений. Возникновение устойчивости зарегистрировано к каждому без исключения классу противомикробных препаратов. Она может развиваться на любом этапе достижения терапевтического эффекта (и даже на нескольких сразу). Основные механизмы развития устойчивости [1, 2]:
- Изначально устойчивые штаммы. Например, некоторые грамотрицательные бактерии имеют наружные клеточные мембраны, защищающие их клетки от действия ряда пенициллинов и цефалоспоринов.
- Спонтанные мутации, которые приводят к появлению организмов, устойчивых к антибиотикам.
- Передача генов устойчивости к антимикробным препаратам — самый распространенный и важный механизм развития антибиотикорезистентности.
Устойчивость к антибиотикам — глобальная проблема, которая может иметь непредсказуемые последствия для каждого из нас. Увы, но огромный вклад в ее существование вносят сами потребители. Об этом уместно напомнить покупателям с рецептами на антибиотики, подчеркнув, что существенно снизить риски развития устойчивых штаммов позволяет прием противомикробных препаратов только по назначению врача и четкое соблюдение дозы и режима антибиотикотерапии.
Миф. Чтобы вылечиться побыстрее, нужны сильнейшие антибиотики широкого спектра действия
Правда. Все зарегистрированные антибактериальные препараты можно смело относить к мощным, то есть «сильным», однако выраженность их противомикробного эффекта зависит от множества факторов, объединенных принципами антибиотикотерапии [2]:
- Установка диагноза настолько точная, насколько это возможно. Знание диагноза позволяет определить предполагаемого возбудителя.
- Определение возбудителя, если это возможно.
- Принятие взвешенного решения о назначении антибиотиков.
- Подбор оптимального антибиотика с учетом фармакокинетики и спектра активности.
- Подбор оптимальной дозы и курса лечения (последний при большинстве острых инфекций должен составлять не менее 5–10 дней).
- Контроль эффективности антибиотикотерапии.
В российских реалиях, когда контроль за приемом антибиотиков, откровенно говоря, недостаточен, наиболее остро стоит вопрос некорректного подбора препаратов. Известно, что его осуществляют двумя способами: этиотропным и эмпирическим. В первом случае антибиотик используется целенаправленно против определенного, точно установленного возбудителя. Без сомнения, это рационально и оправданно. Однако идентификация микроорганизма, вызвавшего инфекцию, требует времени, обычно это занимает несколько суток. Когда процесс протекает остро и больному требуется немедленная помощь, выделение возбудителя — необоснованная роскошь. В такой ситуации назначают эмпирическую терапию, подбирая лекарство с учетом наиболее вероятных возбудителей [3]. Например, самый частый возбудитель пневмонии — пневмококк, цистита — кишечная палочка и так далее.
Если антибиотик был подобран корректно и все остальные принципы антибиотикотерапии были соблюдены, он, без сомнения, окажется «сильным». А вот тот же препарат, применяемый неправильно (независимо от того, на каком этапе была сделана ошибка), может проявить «слабость» и не оказать терапевтического действия.
Миф. Хотя многие сульфаниламидные препараты почти ушли в прошлое, ко-тримоксазол по‑прежнему сохраняет свои позиции
Правда. Сульфаниламиды стали первыми эффективными химиотерапевтическими средствами, успешно применяемыми для профилактики и лечения бактериальных инфекций. И хотя область их применения значительно сузилась с появлением пенициллина, а позже и других антибиотиков, некоторые их представители длительное время занимали нишу в ряду антимикробных препаратов. Речь в первую очередь идет о синергической комбинации триметоприма и сульфаметоксазола, известной под МНН ко-тримоксазол.
Ко-тримоксазол представляет собой мощный селективный ингибитор микробной дигидрофолатредуктазы — фермента, восстанавливающего дигидрофолат до тетрагидрофолата. Блокирование этой реакции обеспечивает нарушение образования пуриновых и пиримидиновых оснований, нуклеиновых кислот и таким образом подавляет рост и размножение микроорганизмов [4]. Однако в последние годы резко увеличилось количество штаммов микробов, резистентных к ко-тримоксазолу, и распространенность устойчивости продолжает быстро нарастать.
Предполагается, что ранее чувствительные к препарату микроорганизмы в ходе эволюции приобрели внехромосомные молекулы ДНК (плазмиды), которые кодируют измененную дигидрофолатредуктазу. Благодаря им устойчивость к ко-тримоксазолу формируется у каждого третьего изолята кишечной палочки в моче [4]. Положение с остальными штаммами уже чувствительных к лекарству бактерий ненамного лучше. В связи с этим сегодня применение ко-тримоксазола резко ограничено, и препарат практически уступил место более эффективным и безопасным противомикробным препаратам [5].
Миф. Пероральные цефалоспорины такие же «сильные», как и парентеральные
Цефалоспорины (ЦС) — один из самых обширных классов антибиотиков, представленных как в пероральной, так и парентеральной форме. При этом выраженность антибактериального эффекта в первую очередь определяется принадлежностью к одному из четырех поколений. Антибиотики цефалоспорины 1 поколения — парентеральный цефазолин и пероральный цефалексин — имеют самый узкий спектр активности, схожий со спектром аминопенициллинов (ампициллина, амоксициллина) [3]. Цефалоспорины II поколения (парентеральный цефуроксим, пероральный цефаклор) активны в отношении грамотрицательных бактерий, при этом по действию на стафилококки и стрептококки они близки к предшественникам. Таким образом, мощность представителей антибиотиков первого и второго поколений не зависит от лекарственной формы. Но с цефалоспоринами последующих поколений всё не так просто.
Известно, что антибиотики третьего поколения обладают более высокой по сравнению с ЦС-I и ЦС-II активностью в отношении грамотрицательных бактерий, пневмококков и стрептококков. Однако их пероральные формы цефиксим и цефтибутен определенно обладают более узким спектром активности, чем парентеральные цефтриаксон, цефтазидим и цефоперазон. В частности, препараты для приема внутрь не действуют в отношении пенициллинорезистентных пневмококков, что связывают с их относительно невысокой биодоступностью. Так, биодоступность цефиксима составляет всего 40–50 %, в то время как у парентеральных форм она приближается к 100 % [3].
Тем не менее, цефиксим считается мощным антибиотиком, применение которого оправдано при инфекциях мочевыводящих путей, а также среднем отите и фарингите. Цефтибутен используют гораздо реже: он показан только для терапии острых бактериальных осложнений хронического бронхита, среднего отита, фарингита и тонзиллита. Существенный недостаток этого препарата — низкая активность в отношении золотистого стафилококка [4]. В то же время парентеральные цефалоспорины третьего поколения широко применяются для лечения тяжелых инфекций верхних, нижних дыхательных путей, желчевыводящих путей, мягких тканей, кишечных инфекций, сепсиса и других [3].
Миф. Хлорамфеникол — «сильный» безопасный антибиотик при кишечных инфекциях
Правда. С одной стороны, хлорамфеникол на самом деле имеет широкий спектр активности, включающий грамположительные и грамотрицательные кокки, грамотрицательные палочки, в том числе кишечную и гемофильную, а также возбудителей кишечных инфекций — сальмонелл, шигелл и так далее. Но, с другой стороны, препарат связан с не менее широким спектром неблагоприятных реакций.
Известно, что хлорамфеникол угнетает кроветворение, вызывая тромбоцитопению, анемию и даже фатальную апластическую анемию (хотя и всего в 1 случае на 10 000–40 000 пациентов) [3]. Кроме того, он оказывает гепатотоксическое, нейротоксическое действие и проявляет другие побочные эффекты. Ввиду крайне неблагоприятного профиля безопасности хлорамфеникол считается антибиотиком резерва и назначается исключительно в случаях, когда польза от его применения превосходит риск побочных эффектов. Это происходит, если по каким‑то причинам не удается подобрать другой препарат антибактериального действия [3, 5].
Миф. Тетрациклины традиционно «слабые», значительно менее мощные антибиотики, чем пенициллины
Правда. На самом деле тетрациклины имеют широкий спектр антибактериальной активности, причем современные их представители действуют в отношении еще большего количества бактерий, чем их предшественники, включая ряд возбудителей, устойчивых к другим классам антибиотиков. Так, тигециклин, появившийся на рынке только в середине 2000‑х, был разработан в рамках программы по борьбе с растущей антибиотикорезистентностью таких «сложных» в этом плане возбудителей, как золотистый стафилококк и кишечная палочка [6].
Тетрациклины, в том числе и применяемые на протяжении десятилетий тетрациклин и доксициклин, способны проникать внутрь клетки, поэтому они и сегодня широко применяются для лечения внутриклеточных инфекций, передающихся половым путем (хламидиоза, уреаплазмоза, микоплазмоза). К показаниям к их назначению относится и хеликобактерная инфекция — в составе эрадикационной терапии. Благодаря результативности в отношении Propionibacterium acne тетрациклины наряду с макролидами применяются для лечения угревой болезни. Миноциклин, чей спектр включает Neisseria meningitidis, используется для профилактики менингококковой инфекции [2].
В качестве ложки дегтя следует упомянуть и о том, что для большинства тетрациклинов (за исключением современных представителей) свойственны высокий уровень вторичной резистентности многих бактерий и к тому же перекрестная устойчивость микроорганизмов [3]. И это, несомненно, во многих случаях снижает их актуальность.
Миф. Фторхинолоны — слишком «сильные» антибактериальные ЛС, поэтому их не применяют для лечения детей
Правда. Фторхинолоны — обширная группа антимикробных препаратов, включающая представителей четырех поколений. Сегодня используются хинолоны последних трех поколений, причем наибольшей активностью обладают антибиотики, принадлежащие к III (левофлоксацин, спарфлоксацин, гатифлоксацин) и IV (моксифлоксацин, клинафлоксацин) поколениям. Их спектр активности включает пневмококков, в том числе пенициллинорезистентных, атипичных возбудителей (хламидии, микоплазмы), большинство грамотрицательных бактерий, стрептококков, анаэробов и другие. К безусловным достоинствам современных хинолонов относятся устойчивость к бета-лактамазам, медленное повление резистентных штаммов, высокая биодоступность пероральных форм препаратов, низкая токсичность, а также длительность действия, позволяющая назначать многие лекарства 1 раз в сутки [7].
Фторхинолоны являются препаратами выбора при инфекциях мочевыводящих, желчевыводящих, дыхательных путей, инфекциях, передаваемых половым путем, гинекологических заболеваниях и так далее [7]. Но при всех своих достоинствах фторхинолоны имеют и ряд недостатков, среди которых возможность поражения хрящевых точек роста костей у детей. Впрочем, этот результат был выявлен во время токсикологических исследований на неполовозрелых животных. Согласно клиническим данным, общее число побочных эффектов фторхинолонов — как по количеству, так и по качеству — у детей и взрослых не отличается [8]. Более того — во всем мире распространена практика использования антибактериальных этой группы у детей [9], хотя в России возраст до 18 лет по‑прежнему остается противопоказанием к их применению.
Миф. Эритромицин — «слабый» макролид, намного уступающий современным представителям этого класса препаратов
Правда. Антибиотик эритромицин, так же как и другие макролиды, обратимо связывается с 50S субъединицей рибосом, нарушая процесс транслокации и образования пептидных связей между молекулами аминокислот и блокируя синтез белков чувствительных бактерий. Невзирая на существование современных представителей класса — азитромицина, кларитромицина и других, — эритромицин по‑прежнему считается препаратом выбора для лечения ряда инфекций, в частности, микоплазменной инфекции у детей, легионеллеза, дифтерии и коклюша [2].
Наряду с высокой активностью, эритромицин выделяется недостаточно хорошей переносимостью. Известно, что у 30–35 % пациентов он вызывает диспепсию, а также имеет ряд других побочных эффектов [3]. В связи с этим на практике нередко отдают предпочтение современным представителям этой группы.
Миф. Амоксициллин такой же сильный антибиотик, как амокисициллина клавуланат – по сути, это один и тот же препарат
Правда. Антибиотик амоксициллин наряду с ампициллином относится к аминопенициллинам расширенного спектра, действующим в отношении грамположительных и грамотрицательных бактерий. Он и сегодня считается самым активным среди всех пероральных лактамных антибиотиков в отношении пенициллин-чувствительных и пенициллин-резистентных пневмонийных стафилококков [4]. Однако нельзя не учитывать, что ряд бактерий выработали устойчивость к пенициллинам и аминопенициллинам в частности. Так, широко распространены устойчивые штаммы гемофильной палочки, пневмококка, энтеробактерий. Выходом из этой ситуации будет применение ингибиторозащищенных аминопенициллинов, таких как амоксициллин/клавуланат и ампициллин/сульбактам, устойчивых к действию бета-лактамаз и имеющих, соответственно, более широкий спектр активности [4].
Таким образом, назначение аминопенициллинов обосновано при легких и неосложненных инфекциях, в то время как при тяжелых и рецидивирующих формах показаны ингибиторозащищенные препараты. При этом путь введения (парентеральный или пероральный) выбирают в зависимости от тяжести инфекции [3].


