Гормоно-лучевая терапия при раке предстательной железы: целесообразность и эффективность
Рак предстательной железы (РПЖ) — одно из наиболее часто встречающихся злокачественных новообразований у мужчин среднего и пожилого возраста. По экспертным оценкам, в России в 2008 г. 9,7% заболеваемости злокачественными новообразованиями у мужского населения пришлось на долю РПЖ.
На сегодняшний день применяются оперативное, медикаментозное и лучевое лечение РПЖ. Между тем данные последних лет, полученные по результатам крупных международных клинических исследований, свидетельствуют опреимуществах комбинированного гормонолучевого лечения у больных РПЖ с неблагоприятным прогнозом. Подробнее об этом методе лечения мы решили узнать у Олега Борисовича Карякина, проф., д.м.н., зав. отделением лучевого и хирургического лечения урологических заболеваний Медицинского радиологического научного центра РАМН.
– Олег Борисович, эффективность лучевой терапии (ЛТ) как метода лечения РПЖ у специалистов не вызывает сомнений. Но как часто бывают случаи, когда только одного местного лечения недостаточно для получения длительной ремиссии? Чем обусловлена целесообразность применения гормональных препаратов в этом случае?
– Начну с того, что РПЖ относится к опухолям, которые чувствительны к ЛТ. Если при других локализациях, например при раке мочевого пузыря, этот метод может быть паллиативным, то в данном случае он достаточно эффективен и сравним с хирургией для больных с I, II идаже III стадией. Как известно, основные критерии в онкологии – это 5-летняя выживаемость и качество жизни пациента. Так вот, если говорить о 5-летней выживаемости, то по эффективности дистанционная ЛТ сравнима с хирургическим вмешательством, но после 5 лет наблюдения преимущество на стороне хирургии. Разница между ними заключается в том, что при ЛТ облучаются и предстательная железа, и лимфатические узлы (ЛУ), и окружающие органы, тогда как при хирургическом вмешательстве полностью удаляются предстательная железа, семенные пузырьки и окружающая клетчатка. Объем удаления ЛУ, в которых могут быть метастазы, определяется хирургом до или во время операции, что также влияет накачество жизни и результаты лечения. Помимо этого проводится гистологическое исследование удаленной ткани, в процессе которого выявляются «находки», которые невозможно обнаружить до операции или проведения ЛТ: проникновение опухоли за капсулу органа (видно только под микроскопом), прорастание в семенные пузырьки, микрометастазы. Методы лучевой диагностики, такие как магнитно-резонансная томография, компьютерная томография, ультразвуковое исследование, сделать это не позволяют. А это крайне важно для последующего лечения, подбора соответствующей тактики.
В последнее время онкоурологи стали широко использовать метод гормоно-лучевой терапии (ГЛТ), и для этого есть все основания. Статистика такова: оперативному вмешательству ввиду поздней диагностики в нашей стране могут подвергаться порядка 20–25% пациентов, находящихся в I, II, или начале III стадии онкозаболевания. У остальных пациентов (40–60%) опухоль уже вышла за пределы органа или имеются отсевы – макроили микрометастазы. Таким больным показана только ЛТ в сочетании с гормональной терапией (ГТ).
ЛТ – локальный метод, при котором определяется мишень для облучения: только ли предстательная железа, либо это будет расширенное поле с захватом всех ЛУ таза. Эту и другие задачи клиницист ставит радиологу для получения максимального терапевтического эффекта. Комбинация ЛТ и ГТ, как правило, показана для пациентов с местно-распространенным раком. У больных II, III, IV стадии РПЖ количество метастазов, которые мы, клиницисты, не видим, может соответственно возрастать, а такая комбинация создает некую пространственную кооперацию. С помощью ЛТ осуществляется местное лечение, а гормоны, в свою очередь, действуют на весь организм, на отсев всех злокачественных клеток, где бы они ни находились. Таким образом, обеспечивается общее и местное воздействие. В этом и состоит усиливающий эффект ГЛТ.
– Какова доказательная база применения ГЛТ? Какие исследования ГЛТ были, на Ваш взгляд, наиболее убедительными?
– Целесообразность применения ГЛТ объяснена и доказана рядом крупных международных клинических исследований. По сути, все основные исследования адъювантного применения аналогов лютеинизирующего гормона – рилизинг-гормона (ЛГРГ) после ЛТ проводились Европейской организацией по лечению иисследованию рака (EORTC) и Радиологической онкологической группой (RTOG) в 90-х годах прошлого века с использованием гозерелина. Достаточно убедительным по своему масштабу является исследование RTOG, которое включало 977 больных РПЖ в III и IV стадии. Пациентам назначали ГТ и ЛТ. В качестве ГТ использовался Золадекс (МН гозерелин). ЛТ назначалась в дозе 60–65 Гр. Исследование доказало преимущество комбинированной ГЛТ посравнению с ЛТ.
Эффективность ГЛТ также была подтверждена протоколами исследования RTOG 9202, в котором участвовало около 1500 больных. Статистически достоверные преимущества были выявлены в группе пациентов, получавших дистанционную ЛТ с длительной ГТ до, во время и на протяжении последующих 2 лет после окончания ЛТ. Отмечено улучшение показателей местного контроля над заболеванием, частоты прогрессирования и увеличения безрецидивной выживаемости по сравнению с больными, которым проводили дистанционную ЛТ и ГТ.
Применение антиандрогенов после ЛТ хорошо обосновано и в самом крупном мультицентровом плацебо-контролируемом исследовании раннего РПЖ по программе ЕРС, в котором пациенты после облучения получали бикалутамид как добавление к хирургическому вмешательству или после ЛТ. В одной группе пациентам оказывали исключительно хирургическую помощь, в другой добавляли препарат Касодекс (бикалутамид) в дозе 150 мг. В ходе исследования было доказано, что применение Касодекса после хирургического лечения илипосле ЛТ приводит к лучшим результатам иговорит в пользу комбинированного лечения для больных ранним РПЖ, которым было проведено радикальное лечение.
– А что Вы можете сказать о риске рецидивов при разных методах лечения РПЖ? Снижался ли он при их сочетании с ГТ?
– Конечно, любой метод терапии в онкологии не исключает рецидива болезни. Этот риск есть и будет, потому что все ныне существующие методы лечения рака неспецифичны по отношению к причине возникновения злокачественного образования. Основные 3 метода лечения: хирургический, ЛТ и химиотерапия (или ГТ) не направлены на причину появления рака, на те молекулярные изменения, которые возникают в клетках опухоли вследствие генетических нарушений либо воздействия внешних факторов. Поэтому рецидив вполне возможен. Другая причина его возникновения связана с сегодняшним уровнем диагностики, который, к сожалению, не позволяет с достаточной точностью выявить изменения, происходящие в организме человека и определить стадию заболевания. В результате процент ошибок по местному распространению РПЖ достигает 30%. Возможны неточности и при патологии в ЛУ. Неверно определенная стадия, в свою очередь, приводит к неправильно построенной тактике лечения и возможности рецидива. Не исключена его возможность и при использовании ГЛТ. Если говорить о биохимическом рецидиве, то следует напомнить, что контролем эффективности лечения РПЖ помимо обычных рентгенологических методов исследования крови, является исследование маркера ПСА простатспецифического антигена (гликопротеина), который обнаруживается в экскреторных протоках простаты. Все мужчины в возрасте 40–50 лет должны не только знать об этом маркере, но и регулярно сдавать анализ для определения его уровня в крови. Превышение нормы, составляющей 4 нг/мл, должно вызвать подозрение на появление злокачественного новообразования в предстательной железе, потребовать консультации уролога и проведения дифференциальной диагнстики.
Если после проведения ГЛТ уровень ПСА снижается, например с 30–35 до 1 нг/мл, то это считается очень хорошим результатом, и вероятность рецидива и дальнейшего развития болезни у такого пациента невелика. Если же снижение не столь существенное – до 10 нг/мл, то это говорит о том, что с помощью ГЛТ не удалось добиться необходимого клинического эффекта и можно ожидать прогрессирования болезни.
Исходя из протокола RTOG 8610, 10-летняя выживаемость больных РПЖ была достигнута в том случае, когда ГТ сочетали с ЛТ. При проведении комбинированной терапии безрецидивная выживаемость также была выше. В протоколе EORTC 22863, включавшем 415 больных, также использовалась дистанционно-лучевая терапия, а из гормональных препаратов Золадекс, 1 раз в 4 нед с первого дня начала дистанционно-лучевой терапии и в последующем напротяжении 3 лет. За период наблюдения, равный 9,1 года, показатели общей выживаемости составили 58% при комбинированном лечении и 39% – при только ЛТ. Эти различия достоверны.
– Олег Борисович, в вашем отделении проводится анализ результатов ГЛТ. Вы готовы ими поделиться?
– Да, наша клиника участвует в многоцентровых исследованиях с 1994 г., в первую очередь в протоколах EORTC. Ранее я был ответственным за эту работу по России и привлекал к ней другие клиники. Мы накопили достаточный опыт, а сейчас работаем и с другими компаниями и исследовательскими группами по тем протокольным исследованиям. Для нас важно принять участие в разработке новых технологий и потом, возможно, внедрить их в России и, конечно, приобрести новые знания.
В настоящее время в нашем отделении уже накоплен значительный опыт по проведению ГЛТ. Сейчас готовится диссертация одного из аспирантов. Думаю, что в ближайшие несколько месяцев мы сможем опубликовать эти материалы в широкой печати.
Но уже эти предварительные данные показывают достаточно высокую эффективность сочетания ГТ и ЛТ у больных с локализованным и местно-распространенным раком.
– Какие основные проблемы, по Вашему мнению, стоят сейчас перед онкоурологами-радиологами? Что, на Ваш взгляд, необходимо предпринять для улучшения качества оказания медицинской помощи пациентам, получающим лечение в радиологических центрах?
– В настоящее время онкологические больные лечатся как в крупных онкологических центрах, так и в областных онкодиспансерах , которые, к сожалению, не всегда оснащены хорошей радиотерапевтической аппаратурой. Да и радиологические центры по оснащенности также заметно отстают от европейских центров. Поэтому во многих российских онкоцентрах не применяют современную ГЛТ, а назначают лишь ГТ, что совершенно не оправдано инегативно влияет на результаты лечения.
Наряду с оснащенностью радиологических центров и онкодиспансеров необходимым оборудованием не менее остро стоит вопрос о подготовке высококвалифицированных кадров, поскольку радиологическое лечение весьма опасно при его неправильном применении: при ошибке планирования либо ошибки в дозиметрии могут возникнуть достаточно серьезные осложнения. Замечу, что у нас есть отделение лучевых повреждений, где лечатся пациенты, имеющие очень серьезные повреждения после ЛТ.
Что касается лекарственного обеспечения, то оно сегодня также является большой проблемой. Больной по окончании лечения в центре должен получать поддерживающую ГТ по месту жительства, но не всегда эти препараты есть в наличии и покрываются программой дополнительного лекарственного обеспечения. Больные, которые не могут их приобрести из-за отсутствия личных средств, оказываются недолеченными.
Конечно, проблемы есть как в онкоурологии, так и во всей российской медицине. Но наша задача – сделать их минимальными, чтобы организационные вопросы не отражались на здоровье пациентов.
Лучевая терапия при раке простаты

Лучевая терапия рака простаты – альтернатива радикальной простатэктомии. Цель облучения заключается в уничтожении опухолевых клеток. Наиболее часто проводится лучевая терапия с использованием современных линейных ускорителей. Злокачественную опухоль лечат с разных направлений и в несколько сеансов. Это позволяет уменьшить побочные эффекты.
Лечение рака предстательной железы лучевой терапией тормозит деление раковых клеток, останавливая рост опухоли. Эффект лучевой терапии наступает спустя некоторое время. Радиотерапия значительно уменьшает, а также полностью устраняет раковые клетки, позволяя контролировать рак предстательной железы. Но и спустя годы возможны рецидивы. Результативно ли проведенное лечение, можно сказать только через 15 лет.
О лучевой терапии при раке простаты
Когда назначается лучевая терапия при раке простаты
При выборе подходящей терапии решающую роль играет возраст пациента, сопутствующие заболевания и опухолевая стадия: ранний рак предстательной железы, локально ограниченный. Облучение является одним из способов остановить рост опухоли и, по возможности, улучшить состояние.
Прежде чем принимать решение об облучении, врач рассматривает альтернативы:
При локально прогрессирующем раке предстательной железы даже при метастазировании из облучения может быть извлечена выгода. В дополнение к облучению назначается антигормональная терапия.
После радикальной простатэктомии адъювантная лучевая терапия имеет смысл. Цель: предотвратить прогрессирование заболевания, а также образование метастазов. Перед облучением нужно взвесить все за и против, т. е. определить, превышает ли польза терапии возможные побочные эффекты.
Показания к проведению радиотерапии при раке предстательной железы:
нераспространенная опухоль в сочетании с гормональной терапией и операцией;
наличие остаточной опухолевой ткани после хирургического вмешательства;
прогрессирующий рак предстательной железы с метастазами (для облегчения симптомов болезни).
Существует также возможность с помощью радиотерапии целенаправленно уничтожать метастазы, которые распространились в печень или легкие. Но этот подход считается экспериментальным и проводится в рамках клинических испытаний. Пациентам лекарства обычно помогают больше – потому что антигормональная терапия и химиотерапия действуют не избирательно, а по всему телу.


Виды лучевой терапии при раке простаты
Для лечения рака предстательной железы доступны следующие методы протонной лучевой терапии:
Чрескожная радиотерапия (дистанционная): «классическая» лучевая терапия, которая проводится на всех стадиях заболевания. Сочетается с дальнейшими методами лечения в зависимости от ситуации.
Брахитерапия (чрескожное облучение): радиоактивный источник вводится непосредственно в предстательную железу. Назначается только при отсутствии метастазов. Эффективность брахитерапии зависит от индивидуального риска рецидива.
Чрескожное облучение имеет наибольший опыт в терапии рака предстательной железы. Предыдущие данные показывают: шансы на выздоровление при локально ограниченном и локально продвинутом раке аналогичны шансам операции (радикальной простатэктомии). При необходимости назначается дополнительная адъювантная гормональная терапия.
Подготовка наружной лучевой терапии, в отличие от самого лечения, относительно трудоемка: доза облучения и лучевое поле рассчитываются с помощью компьютера. Это гарантирует, что облучаться будет только опухоль, а здоровые ткани останутся максимально сохраненными.
Брахитерапия назначается пациентам, у которых опухоль не выходит за пределы предстательной железы. Мужчины, которые предварительно прооперированы из-за доброкачественного заболевания предстательной железы или по другим причинам, обычно не могут лечиться с помощью внутренних радиоактивных источников.
Процедура лучевой терапии при раке простаты
Чрескожная лучевая терапия при раке простаты проводится амбулаторно. Пациент может вернуться домой после сеанса облучения. Лечение длится 7-9 недель. У большинства пострадавших в этот период процедуры проводятся каждый день, за исключением выходных дней. От этого графика возможны отклонения.
Ход процедуры радиотерапии при раке простаты:
Пациент занимает место на кушетке под так называемым линейным ускорителем.
Устройство вращается, воздействуя на опухоль с разных направлений.
Дискомфорт во время процедуры отсутствует.
Один сеанс облучения длится от нескольких секунд до нескольких минут.
Доза облучения распределяется равномерно в течение всего периода лечения, при этом говорят о «фракционировании». Общие показатели терапии составляют 74-80 Гр (одна процедура от 1,8 до 2,0 Гр). Доза рассчитывается в зависимости от стадии опухоли, а также от того, как врачи оценивают риск рецидива.
Современные методы облучения воздействуют преимущественно на опухоль, не повреждая здоровую ткань: интенсивно-модулированная радиотерапия (IMRT) – чрескожное облучение с компьютерным планированием. Объединяет компьютер и облучающее устройство.
Брахитерапия при раке простаты также проводится в амбулаторных условиях:
Пациенту вводится наркоз и устанавливается катетер мочевого пузыря.
Через катетер поступает контрастное вещество в мочевой пузырь для улучшения визуализации при проведении УЗИ. Это гарантирует, что при имплантации радиоактивных источников не возникнет травм.
С помощью полых игл вводятся источники радиации, заполненные радиоактивными частицами металла размером всего в несколько миллиметров. Эти «семена» остаются в предстательной железе.
В качестве источника излучения обычно используется йод-125 или палладий-103. Оба «излучателя» радиоактивны, но имеют короткий период полураспада и диапазон от нескольких миллиметров до сантиметров. Излучение в основном ограничивается опухолью и длится всего несколько недель.
Лучевая терапия при метастазах
Классическое облучение облегчает боль у пациентов с метастазами в кости, а также улучшает стабильность костных структур. Это актуально, если гормональная терапия не дает достаточного эффекта или есть выраженный дискомфорт. Радиотерапия для лечения метастазов при раке простаты не используется, т. к. является не эффективной.


Сочетание лучевой терапии с другими видами лечения
Обычно врачи рекомендуют удалить простату при злокачественном поражении. На 1-2 стадии прогрессирования возможно облучение. Но на 3-4 стадии без операции не обойтись. Радиотерапия в этом случае возможна только при наличии противопоказаний к хирургическому вмешательству.
Лучевая терапия используется до проведения простатэктомии и после операции. Облучение помогает уменьшить размеры злокачественного образования и «добить» поврежденные клетки, которые не были удалены хирургическим путем. Радиотерапия проводится через несколько недель после простатэктомии, что дает возможность тканям восстановиться.
Одно преимущество облучения сразу очевидно: мужчинам не нужно проходить операцию. Хирургическое вмешательство всегда связано с рисками и побочными эффектами, такими как:
кровотечение или присоединение инфекции;
недержание мочи или импотенция;
эректильная дисфункция, связанная с повреждением нервов;
накопление воды в тканях (лимфедема).
Кроме того, мужчины становятся недееспособными после удаления предстательной железы. Это важный аргумент, особенно для тех, кто планирует семью.
Недостатком является то, что для лучевой терапии при раке предстательной железы требуется терпение. В отличие от операции, лечение не выполняется в течение нескольких дней. Нужно ездить в клинику для облучения 5 раз в неделю в течение 6-9 недель.
Рак предстательной железы у большинства больных является гормонозависимым: тестостерон (мужской половой гормон) способствует росту опухоли. В этом случае лучевая терапия сочетается с гормональной: выработка тестостерона медикаментозно подавляется или его действие замедляется, что способствует остановке роста опухоли.
Побочные реакции лучевой терапии при раке простаты
Во время или после облучения рака предстательной железы могут возникать различные побочные эффекты. У большинства пациентов проходит около 3-4 недель до появления выраженного дискомфорта. Нежелательные последствия прекращаются, как правило, после окончания лучевой терапии.
Дискомфорт зависит от дозы облучения и размера лучевого поля – чем целенаправленнее облучение, тем менее вероятны побочные эффекты.
Основные побочные эффекты лечения рака простаты лучевой терапией:
Раздражение кожи в области облучения. Возможно покраснение, зуд или незначительная боль. Более серьезное повреждение кожи встречается редко. Нужно использовать pH-нейтральные средства для личной гигиены и носить свободную одежду.
Воспаление слизистых оболочек в мочевом пузыре и уретре. Пациент ощущает симптомы цистита, так называемого лучевого цистита, редко в моче появляется немного крови. Лечение предусматривает использование обезболивающих средств и спазмолитиков. При присоединении инфекции врач прописывает антибиотики. Если облученная простата сильно набухает, то для мочеиспускания может временно потребоваться катетер.
Воспаление слизистой оболочки в кишечнике. Дефекация может быть временно болезненной, также возможны легкие кровотечения или диарея. Для устранения воспаления назначаются суппозитории кортизона и при необходимости средства от повышенной активности кишечника.
При интенсивно-модулированной лучевой терапии (IMRT) острый дискомфорт после терапии меньше, чем при «классическом» облучении, т. к. мочевой пузырь и кишечник практически не подвергается воздействию лучей.
Возникают также долгосрочные последствия облучения, которые зависят не только от дозы облучения, но и от индивидуальных факторов. Если побочные реакции появляются спустя длительный промежуток времени после окончания лечения, то назначается интенсивный последующий уход. К долгосрочным последствиям относится также склонность к диарее, изменения кишечника, мочевого пузыря и уретры, а также недержание мочи.
В 50% случаев лечения рака предстательной железы мужчины сталкиваются с эректильной дисфункцией. Эта проблема решается с помощью соответствующих медикаментов, которые должен назначить врач. После обычной чрескожной лучевой терапии уже не все мужчины способны зачать детей. Пациенты, у которых все еще есть желание иметь ребенка, должны сделать клиническую процедуру замораживания спермы до начала лечения. На поддержание фертильности ни в коем случае не следует полагаться, даже после брахитерапии.
Любое радиационное воздействие повышает риск развития злокачественных новообразований. У мужчин с онкологией предстательной железы есть вероятность развития рака прямой кишки и, возможно, других тканей, находящихся в лучевом поле. Риск вторичных опухолей увеличивается спустя 10 лет. Через 5-8 лет повышается вероятность развития рака мочевого пузыря на 50%, рака прямой кишки на 70%.
Лучевая терапия рака простаты
В лучевой терапии (радиотерапии) используются волны высокой энергии для лечения рака простаты.

Лучевая терапия рака ростаты применяется:
- Для начального лечения опухоли предстательной железы низкой степени (по шкале Глисона), находящегося в пределах железы.
- Как начальное лечение распространенного рака простаты (выходящего за пределы железы) в комбинации с гормональной терапией.
- В случае неполного удаления опухоли во время операции или ее повторного появления.
- В случае распространенной опухоли предстательной железы с метастазами – для уменьшения размеров опухоли и облегчения симптомов заболевания.
Лучевая терапия рака простаты проводится двумя основными методами:
- наружная лучевая терапия рака простаты;
- внутренняя лучевая терапия, или брахитерапия, также носящая название интерстициальной лучевой терапии рака простаты.
Также существуют методики предотвращения и лечения костных метастазов рака простаты путем введения в организм препаратов, содержащих радиоактивные вещества.
В данной статье мы подробно поговорим о наружной лучевой терапии рака простаты.
Лучевая терапия рака простаты проводиться путем фокусирования радиационных лучей на объекте лечения с помощью специальной машины, располагающейся вне организма человека.
Количество радиации, используемое во время терапии, подбирается индивидуально для каждого пациента и зависит от степени и стадии рака простаты.
По данным литературы существует завимимость результатов лучевой терапии рака простаты от уровня ПСА до начала лечения. У 89-92% мужчин, имеющих до лечения уровень ПСА менее 10 нг/мл, концентрация ПСА оставалась стабильной в течение более пяти лет после лечения. Мужчины с концентрацией ПСА 10-20 нг/мл до лучевой терапии, имели 82-86-процентный шанс отсутствия рецидивав течение пяти лет после лечения. У пациентов с уровнем ПСА более 20 нг/мл лишь в 26-63% случаев наблюдался стабильный уровень ПСА в течение пяти лет после лечения.
Традиционная наружная лучевая терапия рака простаты
Во время облучения используются рентгеновские лучи высокой энергии. Перед началом курса лечения выполняются визуализирующие исследования, такие как МРТ или КТ, для определения точной локализации опухоли. Врач может наносить метки, которые в последующем будут ориентиром для направления радиационных лучей. Существуют различные схемы проведения наружной лучевой терапии рака простаты. Чаще всего сеансы облучения повторяются пять дней в неделю в течение 7-9 недель. Длительность сеанса составляет несколько минут. Для снижения побочных эффектов дистанционной лучевой терапии рака простаты перед процедурой врач внимательно подбирает необходимую дозу облучения и направляет радиационные лучи на область распространения рака.
Стандартная дистанционная радиационная терапия в настоящее время вытесняется более новыми методиками. Современные медицинские технологии позволяют врачу использовать более высокие дозы облучения с минимальным воздействием на здоровые ткани организма.
Трехмерная конформная лучевая терапия рака простаты (3-D КЛТ)

Во время 3-D КЛТ возможно проведение сканирования пациента непосредственно перед процедурой и обработки получаемых данных с помощью специальной трехмерной программы. Это позволяет получать четкое трехмерное изображение опухоли и с высокой точностью регулировать границы облучаемого поля. При этом радиолучи доставляются к очагу поражения под разными углами, а границы облучения полностью соответствуют форме опухоли, что позволяет снизить лучевую нагрузку на здоровые ткани до минимума. Таким образом, 3-D конформная лучевая терапия рака простаты обеспечивает меньшее повреждение расположенных рядом с предстательной железой мочевого пузыря и прямой кишки.

Новейший вид конформной 3-D радиотерапии называется лучевой терапией с модуляцией интенсивности (ЛТМИ). ЛТМИ использует управляемое компьютером устройство, которое кроме определения точных границ опухоли и ее облучения под различными углами, позволяет в режиме реального времени распределять и корректировать воздействие.
Конформная протонная лучевая терапия – еще один вид лучевой терапии рака простаты. В отличие от вышеописанных конформных методик, использующих рентгеновские лучи для облучения, суть протонной методики заключается в доставке к месту облучения высоких доз протонов. Протон – элементарная положительно заряженная частица, являющаяся частью атома. Протоны вызывают меньшее повреждение здоровых тканей по сравнению с рентгеновскими лучами. В настоящее время протонная лучевая терапия еще не получила повсеместного распространения. Установки для конформной протонной терапии отличаются значительной дороговизной.
Ученые университета Северной Калифорнии в течение семи лет тщательно изучали эффективность и надежность протонной терапии. Кроме того, что протонная терапия позволяет осуществлять более точную фокусировку радиационных лучей на опухоли, она была ассоциирована с довольно низкой частотой повторного возникновения рака. Четырехлетняя выживаемость составила более 90%.
Несмотря на хорошие результаты протонной лучевой терапии рака простаты, необходимо проведение более масштабных исследований, изучающих отдаленные последствия лечения данным методом.
Побочные эффекты наружной лучевой терапии рака простаты
Как мы обсуждали выше, благодаря внедрению новых конформных методик частота и выраженность побочных эффектов снизилась.
- Проблемы с прямой кишкой: Во время и после лучевого лечения у мужчин могут развиваться диарея, иногда с примесью крови, синдром раздраженной кишки. Большинство проблем проходит со временем, в редких случаях нормальная функция кишки может восстанавливаться длительное время.
- Проблемы с мочевым пузырем и мочеиспусканием: Мужчину может беспокоить учащенное мочеиспускание, чувство жжения во время мочеиспускания, наличие крови в моче. Эти проблемы также купируются со временем, но у некоторых пациентов могут сохраняться довольно длительно. Например, у одного мужчины из трех может долгое время сохраняться учащенное мочеиспускание. Недержание мочи – более редкий побочный эффект лучевой терапии рака простаты, однако вероятность развития недержания мочи растет с каждым годом после лечения.
- Проблемы с эрекцией, в том числе импотенция: Частота развития импотенции после традиционной лучевой терапии примерно такая же, как и после открытой операции по удалению простаты. Однако в отличие от оперативного лечения, при котором импотенция проявляется сразу после вмешательства, расстройства эрекции после лучевой терапии развивается медленно в течение года или даже больше.
В одном исследовании было показано, что у трех мужчин из четырех нарушалась функция эрекции в течение пяти лет после традиционной лучевой терапии, однако некоторые мужчины исследуемой группы имели проблемы с эрекцией еще до начала лечения. У 50% пациентов, не имеющих проблем с эрекцией до лечения, половая функция нарушается в течение пяти лет после лучевой терапии.
- Чувство усталости: Радиационная терапия может вызывать чувство усталости и быструю утомляемость, сохраняющиеся несколько месяцев после окончания лечения;
- Нарушение оттока лимфы: сопровождается отеком нижних конечностей, вследствие облучения тазовых лимфатических узлов;
- Сужения (cтриктуры) уретры: В редких случаях радиационное излучение может повреждать мочеиспускательный канал, что влечет за собой формирование сужений, приводящих к нарушению нормального оттока мочи.
- Раздражение кожи в проекции прохождения радиационных лучей, потеря волос лобковой области.
Паллиативная лучевая терапия рака простаты
Паллиативная терапия – это лечение, направленное на облегчение симптомов заболевания. Наружная лучевая терапия рака простаты используется для уменьшения объема опухоли и облегчения боли. Иногда в процессе паллиативной терапии могут облучаться большие площади тела низкими дозами радиации. Кроме того лучевая терапия используется для лечения костных метастазов рака простаты. Разрушающиеся раковые клетки заменяются новыми костными клетками, что снижает риск перелома костей.
В случае множественных костных метастазов проводится внутренняя радиационная терапия, заключающаяся во внутривенном введении стронция-89. Радиоизотопы разрушают раковые клетки и позволяют контролировать болевой синдром.
Брахитерапия рака простаты
Брахитерапия, или внутренняя лучевая терапия, – вид лучевой терапии, при которой источник радиоактивного излучения вводится в предстательную железу. Данная тема более подробно освещена в соответствующем разделе.
Лучевая терапия простаты

Лучевую терапию простаты так же называют радиотерапия простаты. Цель лучевой терапии простаты – уничножение больных (раковых) клеток, путем воздействия на них рентгеновских лучей высокой мощности. При этом стараются сохранить, на сколько это возможно, здоровые ткани.
При лучевой терапии простаты, предстательная железа облучается с разных углов, к сожалению при этом уничтожаются не только больные, но и здоровые клетки. В большинстве случаев затронутые здоровые клетки через некоторое время восстанавливаются, так как основная концентрация лучей направлена не на них.
Цель облучения простаты
Облучение простаты показано нескольким группам пациентов:
- пациентам которым противопоказано хирургическое вмешательсво в силу тех или иных обстоятельств (возраст, проблемы с сердечно-сосудистой системой). Облучение проводится без наркоза, ни сердце ни другие органы не испытывают дополнительной нагрузки, поэтому внешнее облучение, как и внутреннее (брахитерапия), показана пациентам находящимся в группе риска.
- если раковая опухоль вышла за капсусу предстательной железы и хирург не видит смысла удалять простату (при продвинутых стадиях рака простаты), может быть показано внешнее облучение предстательной железы.
- после проведения простатэктомии, в случае когда у пациента была обнаружена агрессивная опухоль и/или опухоль вышедшая за капсулу простаты и существует большой шанс на рецидив рака, уролог может рекомендовать облучения простатического ложа.
Чем больше было проведено дополнительных обследований, особенно это относится к пациентам из группы риска и пациентам с продвинутой стадией рака простаты, тем лучше лечащий врач сможет разработать тактику лечения конкретного пациента.
Для определения наиболее эффективной тактики лечения, лечащему врачу необходим не только основной диагноз, но и полный анамнез пациента. Например, при лечении рака простаты 3 стадии пациентам в определенных случаях, могут быть показаны различные тактики лечения: простатэктомия или облучение, или простатэктомия с последующей химиотерапией.
Как проводят лучевую терапию простаты
Полный курс лучевой терапии простаты длиться около 7 недель. В общем проводится от 19 до 39 сессий облучения в зависимости от конкретного случая. Пациент не прибывает в клинике стационарно, ему необходимо ежедневно приходить для сессии облучения, которая длится около 5 минут, в радиологическое отделение клиники.
Применяемый аппарат для внешнего обучения простаты называется линейный ускоритель. Аппарат концентрирует рентгеновские лучи высокой мощности и направляет их на предстательную железу с целью разрушить их и прекратить их деление. Раковые клетки больше подвержены воздействию радиации чем здоровые, тем самым существует возможность сохранить больше здоровых клеток.
Отдел радиологии располагает специальным оборудованием и програмным обеспечением для 3-х мерного моделированя предстательной железы, ее точной локализацмм относительно других органов, размера и формы. Делается это для того, чтобы как можно меньше здоровых тканей организма не было затронуто радиактивными лучами.
Во время облучения пациент находится на специальном столе, вокруг него движется линейный ускоритель и воздействует рентгеновскими лучами на предстательную железу.
Радиотрапия направлена на прекращение роста опухоли, смягчение болевых ощущений у пациентов с продвинутой стадией рака.
Побочные действия лучевой терапии простаты
При выборе медицинского учреждения где будет проводится лучевая терапия необходимо уделить особое внимание опыту специалистов, которые будут проводить терапию. Побочные действия, связанные с некачественным проведением облучения простаты могут принести пациенту большое количество проблем со здоровьем. Возможые пробочные эффекты связаны с нарушением функций или частичного разрушения:
- кишечника
- анального отверстия
- стенку прямой кишки
- уретры (мочеиспускательного канала)
Вышеописанные побочные действия могут быть как временными так и постоянными. Так же после облучения может возникать общая слабость, иногда тошнота.
Где проводить лучевую терапию простаты?
Пациент решивший проводить курс лучевой терапии в Германии, должен расчитывать на длительное прибывание в непосредственной близости от клиники. Процедуры облучения проводятся каждый день с перерывами на выходные.
Средний курс облучения содержит 33 сессии. Облучение не подразумевает стационарного пребывания и проводится амбулаторно.
Лучевая терапия при онкологии простаты
Существует лишь несколько подходов к лечению рака простаты, в отношении которых, даже среди урологов-онкологов, высказываются столь разные мнения. Многие согласны с тем, что при локализованной форме рака предстательной железы и при отсутствии метастазов вне тазовой области и в костях следует попытаться провести комплекс лечебных мероприятий носящих локально-консервативный характер.
Однако некоторые урологи продолжают считать, что количество случаев болезни, находящейся в ранней стадии (TI), так мало, что подтвердить эффективность локализованного подхода нереально, и во многих подобных ситуациях предпочитают использовать паллиативные методы лечения. Более радикально настроенные хирурги готовы удалить простату даже в тех случаях, когда опухоль распространяется только на ткани, расположенные в непосредственной близости от железы (опухоли до стадии III).
Для того чтобы уменьшить размер опухоли перед операцией, иногда используется гормонотерапия.
Существует два возможных подхода к лечению: радикальная простатэктомия и радикальная лучевая терапия. Радикальная хирургическая операция удаления предстательной железы с начала XX века постепенно начала приобретать популярность. Сейчас в ходе этой операции удаляется вся предстательная железа, частично мочеиспускательный канал, и семенные пузырьки вместе с окружающей соединительной тканью (фасцией Денонвилье). Операция показана только для больных, у которых опухоль не распространилась за пределы капсулы органа и метастазы отсутствуют.
Эта операция всегда была более популярна в США, чем в Великобритании. Доступ к железе возможен с позадилонной стороны или со стороны промежности. При доступе с позадилонной стороны при наличии показаний также возможно провести лимфоаденоэктомию тазовой области. Осложнения после операции описаны ниже.
Хотя радикальная лучевая терапия получила распространение сравнительно недавно, она используется более широко, чем хирургический метод лечения. Связано это с тем, что метод не имеет технических ограничений и может применяться в случаях, когда опухоль выходит за пределы капсулы или при ее боковом распространении.
По сравнению с радиологией, хирургия требует более основательной общей подготовки специалиста. Простата довольно устойчива к высоким дозам излучения, хотя переоблучение окружающих органов (мочевого пузыря, части мочеиспускательного канала и толстой кишки) может привести к серьезным осложнениям.
Трансперитонеальная интерстициальная имплантация источников излучения в предстательную железу.
Для достижения высокой локальной дозы (более 160 Гр) используются микроисточники I 125 .
Определение местонахождения предстательной железы проводится с помощью трансрсктального ультразвукового сканирования, что позволяет не прибегать к полостной операции/
При облучении больных, отобранных для проведения курса лучевой терапии, на всю железу и на примыкающую область дается большая доза радиации. Хотя раньше практиковалось интерстициальное облучение с использованием техники имплантации радиевого источника в простату, сейчас предпочитают облучать внешним пучком.
Согласно общепринятой точке зрения, для проявления цитотоксического эффекта общая поглощенная доза облучения должна быть не менее 70 Гр. Облучение должно проводиться в режиме фракционирования дозы в течение 7 недель (или за более короткий период, при соответствующем увеличении фракции дозы). В настоящее время растет число сторонников применения более высоких доз. Некоторые онкологи рекомендуют облучать также тазовую область, мотивируя это возможностью локального распространения опухоли или наличием метастазов в лимфоузлах, которые не были обнаружены при обследовании.
Правда сейчас число сторонников этой точки зрения становится меньше, чем 20 лет назад. Оптимальный размер облучаемой области является предметом дискуссий, так же как при раке мочевого пузыря. Радиологи, предпочитающие не облучать тазовую область, отмечают, что профилактическое облучение тазовых лимфатических узлов не увеличивает выживаемость больных. Если не облучать тазовую область, то оказывается возможным дать большую дозу на основную мишень — первичную опухоль.
Для достижения высокого уровня поглощенной дозы применяется различная техника облучения. Всегда необходимо облучать в режиме наложения множественных полей, иногда следует отдавать предпочтение высоковольтному оборудованию. Все более широко применяется радикальная конформационная лучевая терапия, и облучение с использованием метода модуляции интенсивности дозы. При этом снижается побочный эффект радиации на прямую кишку, который проявляется в развитии проктита и ректальных кровотечений.
Альтернативой внешнему облучению является применение интерстициальных имплантов, содержащих микроисточники радиоактивного изотопа, обычно 125 I как источник облучения органа, а при необходимости и примыкающих тканей. При этом достигается очень высокая локальная доза излучения (превышающая 160 Гр) при относительно небольшом побочном эффекте. За последние 5 лет техника стала очень популярной. В таблице ниже сведены результаты лечения рака предстательной железы с применением различных схем лучевой терапии, полученные в различных клиниках США.
К числу недавних и перспективных методов относится брахитерапия с применением кратковременного облучения в высокой дозе, обычно с использованием линейного источника 192 Ir, и фотодинамическая терапия (ФДТ) с использованием внутриорганной имплантации источника под прямым визуальным контролем.
Сообщалось, что продолжительость жизни больных после проведения радикальной хирургической операции оказалась сравнимой с ожидаемой для мужчин соответствующей возрастной группы. Однако группы сравнения не были рандомизированы, и в контрольной группе не учитывались анамнестические данные.

1 PSA 2 Восьмилетний результат.
3 По достижении минимального уровня не наблюдалось двух последовательных волн подъема уровня PSA.
4 Три последовательных волны подъема PSA, наблюдаемые по достижении минимального уровня, было принято считать признаком неэффективности лечения.
5 Пятилетний результат.
6 Девятилетний результат.
Результаты радикального лечения рака простаты
Оценка результатов лечения рака предстательной железы затруднительна, поскольку симптоматика самого заболевания неопределенна, и часто оно протекает безболезненно. Кроме того, необходимо учитывать, что в любой группе пожилых мужчин будет наблюдаться повышенная смертность. Однако последние данные MRC подтверждают точку зрения о необходимости возможно более раннего медицинского вмешательства, даже в случаях, когда опухоль находится на поздних стадиях развития.
В нескольких клиниках после проведения курса лучевой терапии наблюдались большие группы больных. При этом часть больных наблюдалась достаточно долго и, вероятно, даже продолжала лечиться, хотя трудно конкретизировать, что вкладывалось в это понятие применительно к мужчинам пожилого возраста. Так, в одной из групп 136 больным с локализованной опухолью была сделана операция лимфаденэктомии, без удаления предстательной железы, и назначен курс радикальной лучевой терапии.
Спустя 15 лет у 60 человек (44%) не было обнаружено рецидивов опухоли; при этом 34 человека из 60 умерли от других причин. При наблюдении за этими больными следует иметь в виду, что после облучения предстательной железы биоптаты в течение некоторого времени (до одного года) еще могут содержать злокачественные клетки. При этом клинические данные не свидетельствуют о том, что лечение было неэффективным. До 60% больных с локальной опухолью могут показывать положительные результаты анализа биоптатов на протяжении срока до 9 месяцев после лечения.
При анализе биоптатов через 12-30 месяцев без проведения дополнительного лечения положительный результат получен лишь у 24% больных. Попытки разработать основные руководящие принципы терапии локализованных форм рака предстательной железы привели к мнению о том, что результаты хирургического лечения и лучевой терапии примерно одинаковы, или что, по крайней мере, имеющиеся результаты не позволяют прийти к однозначному выводу. Крайне важную роль играет отбор групп больных. Интересно, что наблюдение за больными с локализованными опухолями, находящимися на начальных или промежуточных стадиях роста, позволили прийти к выводу о том, что «за 5-10 лет увеличение выживаемости больных можно выразить более, чем скромной цифрой» Это высказывание противоречит данным, изложенным в отчете MRC.
В таблице ниже перечислены осложнения, наблюдаемые при лечении рака предстательной железы. Осложнения хирургического лечения включают летальность самой операции (1,5-5%), развитие у большинства больных устойчивой импотенции (если при операции не применялись меры к сохранению соответствующих периферических нервов), частые позывы на мочеиспускание и недержание мочи (около 10-15%).
Также могут наблюдаться ректовезикальные фистулы и повреждения мочеточников. Важнейшие осложнения радикальной лучевой терапии включают диарею, дизурию и реакцию кожи промежности, иногда сильную. К числу отдаленных последствий относятся развитие подкожного фиброза, стриктура мочеиспускательного канала, и уменьшение емкости мочевого пузыря за счет фиброзного разрастания эпителия. При облучении с заполненным пузырем экранируется область тонкого кишечника. После лучевой терапии отмечается относительно низкий процент случаев развития импотенции, что является ценным преимуществом метода.

Радикальная хирургическая операция или гормональная терапия рака предстательной железы всегда приводят к импотенции, если при операции не предпринимаются меры по сохранению соответствующих периферических нервов. Однако даже после радикального облучения предстательной железы количество случаев развития импотенции не превышает 50%. Использование техники проведения простатэктомии с сохранением периферических нервов за последние 10 лет привело к увеличению популярности хирургического метода лечения рака предстательной железы, по крайней мере в США. К числу дополнительных методов, позволяющих снизить риск развития побочных эффектов, относится лапароскопическая хирургия и/или стимуляция нерва во время операции.
Исследуются возможности применения криохирургии и сфокусированного пучка ультразвуковых волн высокой интенсивности.
Несмотря на колоссальный клинический опыт, накопленный в области радикальных методов лечения различных стадий рака предстательной железы, еще существуют сторонники политики выжидания и тщательного наблюдения за ходом болезни. Такую политику нельзя считать разумной. В течение 20 лет шведские онкологи наблюдали за больными раком предстательной железы. Оказалось, что в ряде случаев прогрессирующий рост опухоли и образование метастазов наблюдались только через 15 лет.
Всего под наблюдением находилось 223 больных с локализованным раком предстательной железы на ранней стадии развития. При локализации опухоли в пределах органа больные не проходили курс первичного лечения. Если выявлялось развитие опухоли с появлением соответствующих симптомов, больным назначали эстрогены или проводили орхиэктомию. В течение первых 15 лет в большинстве случаев рак развивался безболезненно: 25 больных (11%) умерли от рака предстательной железы. За время наблюдения умерли еще десять больных. Тем не менее в период от 15 до 20 лет отмечалось существенное снижение кумулятивной выживаемости без признаков заболевания (с 45% до 36%).
Также снизилась выживаемость в группе больных без признаков метастазирования опухоли (с 76,9% до 51,2%) и в группе, в которой единственной причиной смертности был рак предстательной железы (с 78,7 до 54,4%). В течение первых 15 лет смертность от рака простаты увеличилась с 15 на 1000 (95%-й доверительный интервал составлял 10-21 на 1000) человеко-лет до 44 на 1000 (22-88 на 1000) человеко-лет в последующем периоде наблюдения (Р=0,01). В одной из последних публикаций сообщается о том, что темп увеличения уровня PSA после проведения радикальной простэктомии может служить хорошим прогностическим фактором.
Видео этиология, патогенез рака простаты
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Протонная терапия и современное лечение рака простаты
Рак простаты – одно из наиболее сложных в диагностике онкозаболеваний. Но и лечение рака простаты имеет ряд существенных особенностей. О том, почему протонная терапия, уже доступная в России, стала эталоном эффективности лечения рака простаты без операции – наша статья.
Широко известен термин “Аденома простаты”. Нет, это не рак. Это разрастание клеток предстательной железы, приводящее к сдавливанию растущей простатой окружающих структур, что и приводит к наиболее распространенным симптомам – трудностей с мочеиспусканием, неполным опорожнением мочевого пузыря и т.д. Аденома простаты не несет прямой угрозы организму, хотя и способна значительно снизить качество жизни мужчины.
Гораздо опаснее два популярных в обществе мнения: “аденома простаты – безопасна” и “лечение рака простаты – крайне травматично и чревато серьезными побочными эффектами” (чем конкретно пугает лечение рака простаты – поговорим в одном из следующих разделов статьи).
Первое “мнение” о безопасности аденомы предстательной железы приводит к игнорированию нарастающих симптомов. Второе “заблуждение” о том, что лечение рака простаты проводится только хирургическим способом, становится причиной позднего обращения к врачу, даже на той стадии, когда развился метастатический рак простаты и речь может идти о продлении жизни, а не о полном излечении.
Не так страшен рак простаты, как его метастазы
Симптомы рака простаты практически идентичны тем, что отмечает пациент с аденомой предстательной железы. И если их характер нарастает, то следует запланировать визит к врачу в ближайший день-два.
Справедливости ради, следует отметить – рак простаты чрезвычайно распространенное заболевание. И уровень смертности, который можно найти в статистике (в среднем, 3-4 место среди онкозаболеваний у мужчин), – завышен. Это связано с тем, что подавляющее большинство случаев рака простаты не регистрируются – зачастую мужчина даже не догадывается о наличии у него злокачественного заболевания предстательной железы до конца жизни. Та же аденома простаты растет гораздо быстрее, отчего ее симптоматика носит более выраженный характер. В большинстве случаев рак простаты не метастазирует, поэтому часто пациентам не показано лечение.
Но в тех случаях, когда у пациента развивается агрессивный рак простаты, опухоль растет быстро, нередко не только сдавливая окружающие ткани, но и прорастая в них. Наиболее явно об этом скажет кровь в моче и боли при мочеиспускании, реже – семяизвержении. Но помимо разрастания самой опухоли, приводящего к резкому появлению и нарастанию симптомов, ее клетки активно распространяются по организму с кровью и лимфой: появляются метастазы рака простаты – опухоли, растущие из “прикрепившихся” злокачественных клеток.
Наиболее вероятные органы-мишени рака простаты:
- легкие
- печень
- лимфоузлы (паховые и подвздошные)
- кости (чаще всего, кости таза)
Учитывая, что множественные метастазы рака простаты с высокой долей вероятности будут столь же агрессивны, как и первичная опухоль, прогноз у таких пациентов, в целом, неблагоприятен.
Лечение рака простаты: можно обойтись без операции?
Информация, приведенная в предыдущем разделе, показывает, насколько важно своевременно выявить новообразование простаты, установить точный диагноз и начать адекватное лечение.
Этого как раз и боятся пациенты, теряющие драгоценное время в изучении методов хирургического лечения рака предстательной железы, пугающих своей травматичностью и последствиями. К счастью, такое лечение рака простаты, как малоэффективная ТУР (трансуретральная резекция простаты) или радикальная простатэктомия (удаление простаты с семенными пузырьками) в современной онкологии уступает место эффективным альтернативам, позволяющим провести лечение без операции. К тому же хирургическое лечение рака простаты имеет какое-либо обоснование при лечении ранних стадий, когда опухоль локализована в пределах железы и нет метастазов.
Динамическое наблюдение
Первый из методов лечения рака предстательной железы имеет неожиданную формулировку – фиксация имеющихся данных о размере, расположении и распространенности новообразования, последующее регулярное прохождение одинакового “набора” обследований с целью своевременного выявления вероятной прогрессии заболевания. Именно динамическое наблюдение при раке простаты (в случае низкой агрессивности опухоли) способно сохранить качество жизни без значительного риска.
Хирургическое лечение
Важность хирургического вмешательства при лечении рака простаты в современной онкологии стремительно уменьшается. Хирургическое удаление – травматично, приводит к серьезным побочным эффектам (импотенция, недержание мочи и кала) и малорезультативно – зачастую рак простаты диагностируется на стадии, когда полное удаление опухоли невозможно. Аналогичным недостатком ввиду сложности визуального контроля обладают методы контактного удаления простаты: криоабляция (разрушение клеток воздействием сверхнизких температур) и ультразвуковая абляция фокусированным ультразвуком высокой интенсивности.
Лучевое лечение рака простаты
Более избирательным является воздействие на злокачественную опухоль простаты ионизирующим излучением. Лечение рака простаты на ранних стадиях может быть успешно выполнено различными методами лучевого воздействия:
- брахитерапия – разрушение опухоли излучением внедренных в ее объем “зерен” радиоактивных препаратов;
- дистанционная лучевая терапия, при которой в зону облучения, как правило, включаются лимфатические узлы;
- радиохирургия – высокоточное подведение разовых доз, вызывающих одномоментную остановку биологических процессов в заданном объеме, совпадающем с опухолью.
Лучевое лечение часто дополняется гормональной терапией проводимой для подавления выработки мужских гормонов, “подпитывающих” опухолевый процесс.
Протонная терапия
Лечение протонами (протонная терапия) – наиболее точный и технологичный метод разрушения опухолевых клеток, позволяющий лечить рак простаты с минимальной лучевой нагрузкой на здоровые ткани организма.
В отличие от фотонной терапии (основная часть современного лучевого лечения использует энергию элементарных частиц фотонов), протонная терапия использует свойства другой элементарной частицы – протона.
Протон отдает максимальную энергию на коротком участке своего “пробега” (пик Брэгга). Точный расчет и подведение пучков защищает от облучения здоровых тканей: на участке от точки входа в организм до границы опухоли энергия протона минимальна, основная доза радиации высвобождается на отрезке в пределах опухоли, после чего энергия протона падает до околонулевого значения,
Лечение рака протонами принципиально напоминает лучевую терапию. Однако, чрезвычайная точность и равномерность подведения заданной дозы ионизирующего излучения при протонной терапии удостоились собственного раздела в классификации методов лечения рака.
Преимущества протонной терапии
- высокая точность доставки излучения – протонная терапия позволяет подводить большие дозы непосредственно к опухоли;
- максимальная защита здоровых органов и тканей от облучения – протонная терапия при раке простаты исключает лучевые реакции, особенно в таких критически важных органах, как мочевой пузырь и прямая кишка;
- лечение протонами неинвазивно и безболезненно – не требуется реабилитация;
- протонная терапия проводится амбулаторно – коллеги и друзья могут и не узнать, с лечением какого заболевания вам пришлось иметь дело.
Протонная терапия в МИБС: важное отличие
Лечение рака протонами все еще воспринимается в обществе, как далекая фантастическая технология из будущего. Так оно и есть. Но с одной важной поправкой – протонная терапия в России – это уже настоящее. Первый в России клинический центр протонной терапии Медицинского института Березина Сергея (МИБС) работает с конца 2017 года, реализуя новейшие методики.
Сканирование карандашным пучком
Центр протонной терапии МИБС предлагает пациентам лечение методом сканирования карандашным пучком (pencil beam scanning, PBS), который является более наиболее совершенным видом протонной терапии. При этой методике пучок протонов безостановочно движется в заданном на виртуальной модели объеме опухоли, аккуратно, словно острием карандаша, “заштриховывая” пиком Брэгга (короткой зоной активного высвобождения энергии протона) объем опухоли. Таким образом, установка протонной терапии позволяет создавать зоны высокой дозы ионизирующего излучения, гибельного для раковых клеток, любой сложной формы и любого объема.
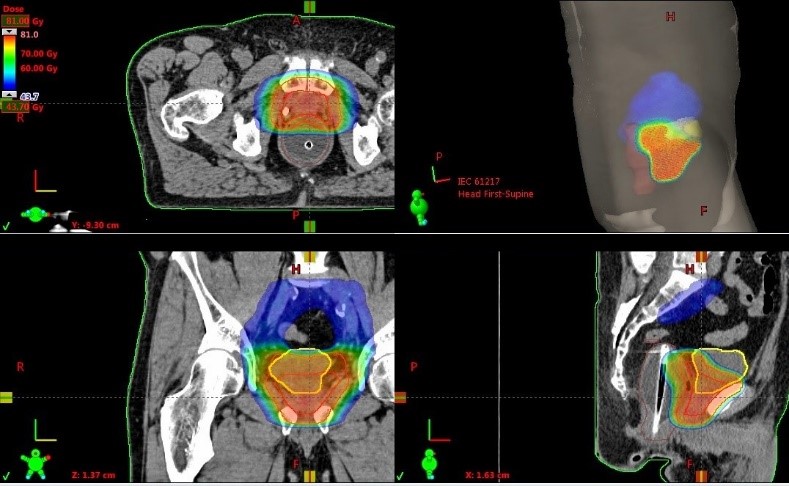
Пример плана лечения рака простаты протонами в Центре протонной терапии МИБС. Пациент Н., 71 год. Выполнена простатэктомия 5 лет назад. Местный рецидив в ложе предстательной железы. Самая эффективная методика в подобной ситуации – воздействие ионизирующего облучения. Самый точный и безопасный способ подведения высоких доз – протонная терапия. Благодаря точности протонной терапии облучение будет подано непосредственно в требуемые зоны: 46 Гр на тазовые лимфоузлы (зона, отмеченная синим), 76 Гр на ложе простаты и зону рецидива (объем тканей, в который будет подведена такая доза, выделен желтым и красным цветом). При этом остальные ткани организма защищены от излучения, которое могло бы оказать влияние на биологические процессы в них.
Лечение рака простаты протонами по методу сканирования карандашным пучком позволяет максимально обеспечить отсутствие побочных эффектов, в первую очередь, защитить пациента от импотенции. Это крайне важно для мужчин, у которых рак предстательной железы был выявлен в относительно молодом возрасте.
Реализовать столь точную технологию лечения рака помогает постоянное сотрудничество МИБС с производителями оборудования и зарубежными центрами протонной терапии.
Как выглядит протонная терапия для пациента с раком простаты?
Во время сеанса пациент находится в сознании (анестезия не требуется, так как протонная терапия безболезненна), удобно расположившись на специальной подвижной платформе (кушетке).
Важным аспектом является то, что сеанс (фракция) протонной терапии длится всего 15-20 минут, и не требует времени на восстановление, сохраняется физическая и сексуальная активность. И пациент, затрачивая на лечение около часа ежедневно, все остальное время может посвятить работе, общению с близкими, хобби и т.д. Таким образом ни коллеги, ни друзья, а, иногда, и члены семьи могут не догадываться о том, с каким заболеванием борется мужчина.
Сохранить конфиденциальность лечения помогают обособленное расположение Центра протонной терапии МИБС и специальные протоколы конфиденциальности, действующие в Клинике.
Длительность лечения рака простаты протонами варьируется в зависимости от индивидуальных особенностей случая (размер и расположение опухоли, получаемое ранее лечение и т.д.).
Чаще всего протонная терапия предусматривает 35-40 сеансов (называемых “фракциями”), которые проводятся пять дней в неделю с перерывом на выходные. Таким образом, курс лечения протонами длится около двух месяцев.
В некоторых случаях возможно «гипофракционирование»: 5 фракций за 5 дней, то есть лечение рака простаты протонами может длиться всего одну неделю. Окончательное решение по количеству фракций и методу (фракционирование или гипофракционирование) принимает врач на основании комплекса факторов, таких как распространенность опухоли, стадия заболевания и т.д.
Сколько стоит протонная терапия рака простаты?
Стоимость лечения онкологического заболевания складывается из стоимости непосредственно лечения первичной опухоли и ее метастазов, а также необходимой поддерживающей терапии и стоимости лечения побочных эффектов, восстановительного лечения, пластической хирургии, реабилитации. Кроме того, при сравнении стоимости различных видов лечения рака следует обращать внимание на уровень ожидаемого качества жизни как во время лечения, так и по его завершению. И обязательно учесть время, в течение которого пациент не сможет выполнять свои профессиональные обязанности (стоимость упущенные возможности)
Таким образом, стоимость протонной терапии рака простаты, более дорогого, но эффективного метода лечения, не требующего дополнительной терапии или реабилитации (и во время которого пациент живет полноценной жизнью), оказывается ненамного ниже, чем стоимость хирургического лечения рака простаты на ранней стадии, которое пока еще проводится в некоторых онкологических и урологических клиниках России.
То, что протонная терапия включена в список методов лечения, покрываемых программами обязательного и добровольного медицинского страхования в США и некоторых странах Европы, – дополнительное подтверждение эффективности метода.
Подозреваете рак простаты? Не откладывайте обращение – звоните в Центр протонной терапии МИБС сейчас!

Воробьев Николай Андреевич
Врач-онколог, врач- радиолог
Заведующий отделением протонной лучевой терапии


